
分析 分析所给的物质可以知道碳酸钠和氯化钡反应生成白色的碳酸钡沉淀,硫酸钠和氯化钡反应生成白色的硫酸钡沉淀,其中硫酸钡不能溶于稀硝酸,而碳酸钡能够溶于稀硝酸,硫酸铜溶于水后得到蓝色溶液,结合题中的“取少量粉末加入足量的水,搅拌、静置,得白色沉淀和无色清液”,可以判断在该粉末中没有硫酸铜,而白色沉淀为碳酸钡沉淀和硫酸钡中的一种或两种,由“将步骤①所得液体过滤,向沉淀中加入稀硝酸,沉淀全部溶解”,说明该白色沉淀为碳酸钡,进而判断在该白色粉末中含有碳酸钠、氯化钡,一定没有硫酸钠,可以据此解答该题.
解答 解:碳酸钠和氯化钡反应生成白色的碳酸钡沉淀,硫酸钠和氯化钡反应生成白色的硫酸钡沉淀,其中硫酸钡不能溶于稀硝酸,而碳酸钡能够溶于稀硝酸,硫酸铜溶于水后得到蓝色溶液,结合题中的“取少量粉末加入足量的水,搅拌、静置,得白色沉淀和无色清液”,可以判断在该粉末中没有硫酸铜,而白色沉淀为碳酸钡沉淀和硫酸钡中的一种或两种,由“将步骤①所得液体过滤,向沉淀中加入稀硝酸,沉淀全部溶解”,说明该白色沉淀为碳酸钡,进而判断在该白色粉末中含有碳酸钠、氯化钡,一定没有硫酸钠,由于没有验证硝酸钾,所以硝酸钾可能存在;结合以上分析可知一定含有碳酸钠、氯化钡,一定没有硫酸钠和硫酸铜;故答案为:Na2CO3、BaCl2;Na2SO4、CuSO4.
点评 本题考查了混合物组成的推断,完成此题,可以结合题干提供的实验现象根据物质的性质进行.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
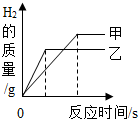 某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(如图).分析图象得到的以下结论中.
某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(如图).分析图象得到的以下结论中.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
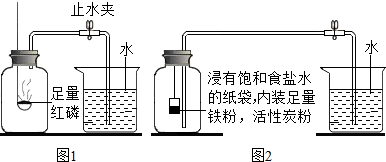
| 测量 项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中水的体积 | 集气瓶(扣除内容物)的容积 | |
| 体积/ml | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com