
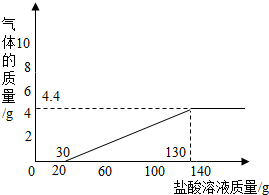
 为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:
为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:| 实验 | 1 | 2 | 3 | 4 | 5 |
| 样品质量/g | 13 | 13 | 13 | 13 | 13 |
| 加入盐酸质量/g | 15 | 30 | 80 | 130 | 150 |
| 反应后物质质量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |
| 106 |
| x |
| 44 |
| 4.4g |
| 117 |
| y |
| 44 |
| 4.4 |
| 10.6g |
| 13g |
| 40 |
| 2.4g |
| 58.5 |
| z |
| 11.7g+3.51g |
| 138.6g |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
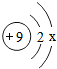 ,其中x为
,其中x为查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
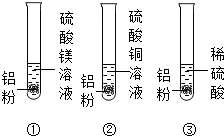 同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后各加入少量的铝粉.
同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后各加入少量的铝粉.| 实验步骤 | 实验现象 | 结论 |
| 向滤出的固体中加入 | 残余固体中含有铜和铝 |
查看答案和解析>>
科目:初中化学 来源: 题型:
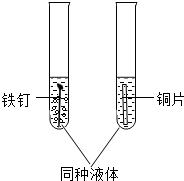 为了验证铁、铜两种金属的活动性差异,可按如图所示取2支试管分别实验,若要立即观察到显著差异的现象,所用液体合理的是
为了验证铁、铜两种金属的活动性差异,可按如图所示取2支试管分别实验,若要立即观察到显著差异的现象,所用液体合理的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com