
| 实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 收集40mL气体所需时间/s |
| ① | 5% | 30 | 48 |
| ② | 10% | 20 | 41 |
| ③ | 5% | 20 | 69 |
| ④ | 10% | 30 | 32 |
分析 (1)根据铝和盐酸反应生成氯化铝和氢气进行分析;
(2)根据实验①③中盐酸的质量分数,温度不同,以及控制变量法进行分析;
(3)根据实验①、③中盐酸的质量分数,以及反应的温度,分析盐酸质量分数为5%,温度为25℃,则收集40mL气体所需的时间;
(4)根据铝的化学性质活泼,易于氧气反应生成氧化铝进行分析;
(5)反应物浓度、反应温度、反应物接触面积、有无催化剂等因素常影响化学反应速率.
解答 解:(1)铝和盐酸反应生成氯化铝和氢气,化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(2)实验①③或②④中盐酸的质量分数相同,温度不同,说明反应时的温度对反应快慢有影响,通过实验②③说明反应物浓度对反应快慢有影响;
(3)实验②中盐酸的浓度是10温度是30℃,需要的时间是41,实验④中盐酸的浓度是10温度是20℃,需要的时间是32,所以盐酸质量分数为,10度为25℃,则收集40mL气体所需的时间范围为:32s<t<41s;
(4)小明在做以上四组实验时,发现一开始反应速率都很慢,原因是:实验前没有除去铝表面的氧化膜;
(5)金属的形状,金属的纯度,反应物的量等因素也会影响化学反应的速率.
故答案为:
(1)2Al+6HCl=2AlCl3+3H2↑;
(2)其他条件相同时,盐酸的浓度越大,反应速率越快; ①③或②④;
(3)32s<t<41s;
(4)铝片可能没有打磨,实验前没有除去铝表面的氧化膜;
(5)金属的形状(或金属的纯度或反应物的量)(答案合理即可).
点评 本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,注意控制变量的运用.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:填空题
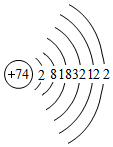 钨(W)是我国丰产元素,广泛用作灯泡的灯丝,有“光明使者”的美誉.
钨(W)是我国丰产元素,广泛用作灯泡的灯丝,有“光明使者”的美誉.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
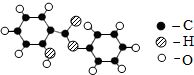 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.| 物质 | B | C | D |  |
微观示意图 |  |  |  |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C u2+、Mg2+、NO3ˉ、SO42ˉ | B. | Na+、H+、NO3ˉ、SO42ˉ | ||
| C. | K+、Na2+、CO32ˉ、SO42ˉ | D. | K+、Clˉ、Ba2+、NO3ˉ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
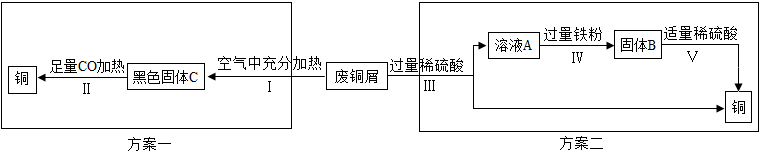
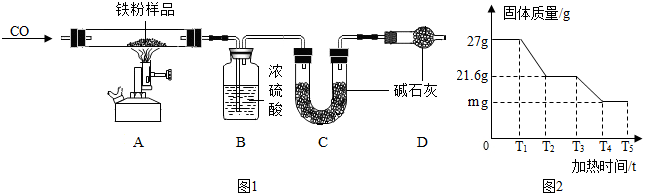
| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
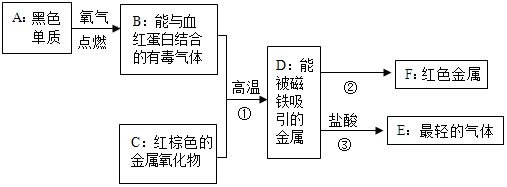
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe+O2$\frac{\underline{\;点燃\;}}{\;}$FeO2 | B. | NaOH+CuSO4═Cu(OH)2↓+Na2SO4 | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2↑ | D. | 2A1+6HC1═2A1C13+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com