
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| 物质 | 所含杂质 | 除去杂质的试剂或方法 | |
| A | Cu粉 | Fe粉 | 用磁铁吸引 |
| B | KNO3 | NaCl | 加热溶解、降温结晶、过滤 |
| C | N2 | O2 | 通过灼热的铜丝 |
| D | CO2 | CO | 在空气中点燃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、“干水”是水 |
| B、“干水”是纯净物 |
| C、“干水”就是“干冰” |
| D、“干水”的应用有利于缓解室温效应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、不变色 | B、变红 |
| C、变蓝 | D、无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:
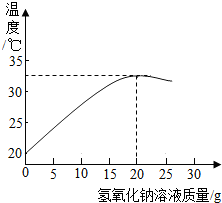 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿 | |
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁 | 试管外壁温度明显升高(合理叙述均可) |
| ③向操作②得到的溶液中放入一段羊毛线,加热一段时间 | 羊毛线逐渐消失 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 稀硫酸用量 | 剩余固体质量 | 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg | 第四次加入10g | 1.0g |
| 第二次加入10g | 2.0g | 第五次加入10g | 0.6g |
| 第三次加入10g | 1.5g | 第六次加入10g | 0.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com