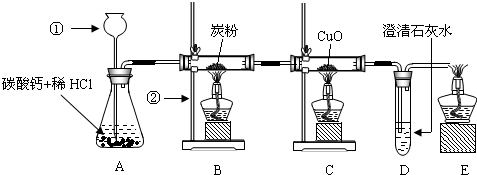
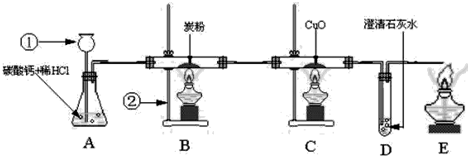
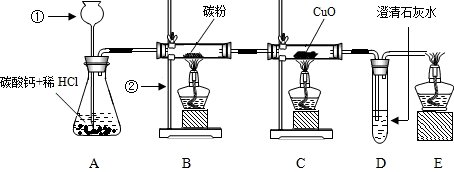
解:
(1)制取二氧化碳:①现象为:有大量气泡产生,固体逐渐减少;
②化学方程式为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
(2)一氧化碳与碳反应:①现象黑色固体逐渐减少;②化学方程式CO
2+C

2CO;
(3)还原氧化铜:①现象:黑色固体逐渐变为红色,固体逐渐减少;②化学方程式CO+CuO

Cu+CO
2(4)检验二氧化碳:①现象:澄清石灰水变浑浊;②化学方程式Ca(OH)
2+CO
2═CaCO
3↓+H
2O
(5)点燃尾气:①现象:气体燃烧,产生淡蓝色的火焰;②化学方程式2CO+O
2
2CO
2;
故答为:
(1)有大量气泡产生,固体逐渐减少;CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
(2)黑色固体逐渐减少;CO
2+C

2CO;
(3)黑色固体逐渐变为红色,固体逐渐减少;CO+CuO

Cu+CO
2;
(4)澄清石灰水变浑浊;
Ca(OH)
2+CO
2═CaCO
3↓+H
2O;
(5)气体燃烧,产生淡蓝色的火焰;2CO+O
2 
2CO
2.
分析:题中图是实验室制取CO
2,并验证CO
2和CO的性质的实验:
(1)用碳酸钙和盐酸制取二氧化碳;(2)二氧化碳和碳高温下反应生成一氧化碳;(3)一氧化碳还原黑色固体氧化铜,生成红色的铜;(4)检验生成的气体是否为二氧化碳;(5)点燃尾气,防止污染空气.
点评:本题主要考查二氧化碳的化学性质及应用,掌握二氧化碳的制取装置和原理,熟记一氧化碳的化学性质和一些常用的化学方程式;学会分析反应现象和本质的联系.

 2CO;
2CO; Cu+CO2
Cu+CO2 2CO2;
2CO2; 2CO;
2CO; Cu+CO2;
Cu+CO2; 2CO2.
2CO2.