梅州市某中学在清理化学实验室发现一包标签为铜粉的绿色粉末,经称重该粉末的质量为80.0克,实验员为了充分利用试剂,将该粉末制成硫酸铜溶液.其实验过程是先在空气中加热该粉末让其充分反应,冷却后称重固体质量仍为80.0克,再溶于适量稀硫酸,得到硫酸铜溶液.(己知铜绿的化学式为Cu2(OH)2CO3)
(1)写出上述过程中制硫酸铜溶液的反应方程式:________;
(2)绿色粉末中单质铜与铜绿的质量比为________;(用分数表示)
(3)若加入稀硫酸的质量为320克,则所得硫酸铜溶液中溶质的质量分数为________.
解:(1)铜与氧气在加热条件下反应生成氧化铜.
该反应的化学方程式为:2Cu+O
2
2CuO.
碱式碳酸铜在加热条件下反应生成氧化铜、水和二氧化碳.
该反应的化学方程式为:Cu
2(OH)
2CO
3
2CuO+H
2O+CO
2↑.
氧化铜与稀硫酸反应生成硫酸铜和水.
该反应的化学方程式为:CuO+H
2SO
4=CuSO
4+H
2O.
(2)设绿色粉末中铜的质量为x,加热后生成氧化铜的质量为y.
2Cu+O
2
2CuO
128 160
x y

=
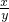
,y=
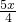
设绿色粉末中铜绿在加热后反应生成氧化铜的质量为z.
Cu
2(OH)
2CO
3
2CuO+H
2O+CO
2↑
222 160
80.0g-x z

=
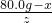
,z=
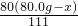
由题意得
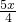
+
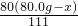
=80.0g
x=
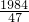
g
铜绿的质量为80.0g-
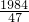
g=

g
绿色粉末中单质铜和铜绿的质量比为
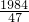
g:

g=124:111
(3)设生成硫酸铜的质量为w.
CuO+H
2SO
4=CuSO
4+H
2O
80 160
80.0g w

=
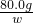
,w=160g
所得溶液中硫酸铜的质量分数为
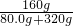
×100%=40%
故答案为:
(1)2Cu+O
2
2CuO,Cu
2(OH)
2CO
3
2CuO+H
2O+CO
2↑,CuO+H
2SO
4=CuSO
4+H
2O.
(2)
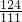
.
(3)40%.
分析:(1)绿色粉末中含有单质铜和铜绿;硫酸铜的制得经过了铜与氧气的反应、铜绿分解和氧化铜与稀硫酸反应三个反应.
(2)单质铜和铜绿的总质量为80.0g;单质铜和铜绿在充分加热后得到的产物都是氧化铜,两个反应得到的氧化铜的总质量也是80.0g.根据这两个质量关系就可以得到单质铜与铜绿的质量比.
(3)由氧化铜的总质量根据氧化铜与稀硫酸反应的化学方程式可以计算出生成硫酸铜的质量;再结合稀硫酸的质量,根据溶质质量分数的计算公式就可以计算出所得溶液中溶质的质量分数.
点评:本题主要考查化学方程式的书写、有关物质质量比、化学方程式和溶质质量分数的计算,难度较大.

 2CuO.
2CuO. 2CuO+H2O+CO2↑.
2CuO+H2O+CO2↑. 2CuO
2CuO =
=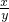 ,y=
,y=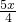
 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑ =
=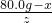 ,z=
,z=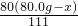
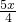 +
+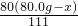 =80.0g
=80.0g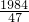 g
g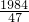 g=
g= g
g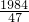 g:
g: g=124:111
g=124:111 =
=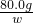 ,w=160g
,w=160g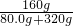 ×100%=40%
×100%=40% 2CuO,Cu2(OH)2CO3
2CuO,Cu2(OH)2CO3 2CuO+H2O+CO2↑,CuO+H2SO4=CuSO4+H2O.
2CuO+H2O+CO2↑,CuO+H2SO4=CuSO4+H2O.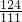 .
.





 向下表的甲物质中逐滴加入相应的乙溶液过量.反应过程中产生的气体或沉淀的质量与乙的质量关系如图所示,符合下图的曲线描述的是
向下表的甲物质中逐滴加入相应的乙溶液过量.反应过程中产生的气体或沉淀的质量与乙的质量关系如图所示,符合下图的曲线描述的是