
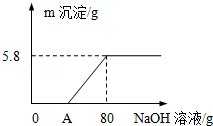
 向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示.请回答:
向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示.请回答:分析 镁和稀硫酸反应生成硫酸镁和氢气,稀硫酸和氢氧化钠反应生成硫酸钠和水,硫酸镁和氢氧化钠反应生成白色沉淀氢氧化镁和硫酸钠,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)设和硫酸镁反应的氢氧化钠溶液质量为x,
由图中信息可知,生成氢氧化镁沉淀的质量是5.8g,
2NaOH+MgSO4═Na2SO4+Mg(OH)2↓,
80 58
x×20% 5.8g
$\frac{80}{x×20%}$=$\frac{58}{5.8g}$,
x=40g,
A点是:80g-40g=40g,
故填:40.
(2)氢氧化镁中的镁元素质量即为参加反应的镁粉的质量,因此镁粉质量为:5.8g×$\frac{24}{58}$×100%=2.4g,
故填:2.4.
(3)设和镁反应的硫酸质量为y,和氢氧化钠反应的硫酸质量为z,
Mg+H2SO4═MgSO4+H2↑,2NaOH+H2SO4═Na2SO4+2H2O,
24 98 80 98
2.4g y 40g×20% z
$\frac{24}{2.4g}$=$\frac{98}{y}$,$\frac{80}{40g×20%}$=$\frac{98}{z}$,
y=9.8g,z=9.8g,
稀硫酸溶质质量分数为:$\frac{9.8g+9.8g}{100g}$×100%=19.6%,
答:稀硫酸溶质质量分数是19.6%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析数据的能力,计算时要注意规范性和准确性.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:填空题
| 被鉴定的物质 | 选择的物质 |
| ①碳酸钠溶液 | 稀盐酸和澄清的石灰水 |
| ②氯化钠溶液 | 硝酸银溶液和稀硝酸 |
| ③硫酸钠溶液 | 硝酸钡溶液和稀硝酸 |
| ④硝酸铵溶液 | 氢氧化钠溶液和石蕊试液 |
| 实验内容 | 实验现象 | 实验结论 |
| 取样于试管中.向其中加如氯化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用过量的稀盐酸除去氯化钠溶液中混有的碳酸钠 | |
| B. | 用碳酸钡鉴别氯化钠和硫酸钠溶液 | |
| C. | 实验室常用电解水的方法制氢气 | |
| D. | 除去BaCl2溶液中的NaCl,先加过量的K2CO3溶液,然后过滤沉淀加盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
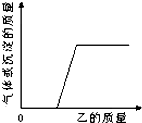 向如表的甲物质中逐滴加入相映的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图所示曲线表示的是( )
向如表的甲物质中逐滴加入相映的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图所示曲线表示的是( )| 序号 | 甲 | 乙 |
| ① | 铜、锌的混合物 | 稀盐酸 |
| ② | 硫酸和硫酸铜的混合液 | 氢氧化钠溶液 |
| ③ | 盐酸和稀硫酸的混合溶液 | 氯化钡溶液 |
| ④ | 生锈的铁钉 | 稀盐酸 |
| A. | ①② | B. | ②④ | C. | ③④ | D. | 只有④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 操作 | 现象 | 结论 |
| 1 | 取样品于试管中,加水,滴入2~3 滴酚酞试液 | 无色酚酞溶液 变红色 | 猜想③ 正确 |
| 2 | 向试管中继续加入过量的 | 有气泡冒出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com