
| 实验步骤 | 实验现象 | 实验结论 |
| 取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,取少量上层清液,滴加1~2滴无色酚酞试液 | 该样品还含有氢氧化钙 |
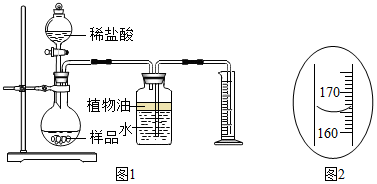
分析 (1)根据氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水写出反应的方程式;
(2)根据氢氧化钙溶液显碱性设计实验并描述现象;
(3)根据碳酸钙和盐酸反应产生氯化钙、水和二氧化碳,写出反应的方程式并描述现象;
(4)根据实验目的分析量筒的作用;
(5)根据量筒的读数方法读数并进行化学方程式的计算;
(6)根据实验目的分析可能产生的误差原因.
解答 解:(1)氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,故反应的方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;故答案为:CO2+Ca(OH)2═CaCO3↓+H2O;
(2)氢氧化钙溶液显碱性,能够使酚酞试液变成红色,因此可以取少量上层清液,滴加1~2滴无色酚酞试液(或其他合理答案);溶液变成红色(或其他合理答案);故答案为:取少量上层清液,滴加1~2滴无色酚酞试液(或其他合理答案);溶液变成红色(或其他合理答案);
(3)滴加稀盐酸和碳酸钙反应产生二氧化碳,至不再产生气泡时说明碳酸钙反应完全,碳酸钙和盐酸反应产生氯化钙、水和二氧化碳;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;无气泡产生;
(4)要测定反应产生二氧化碳的体积,通过气压的增大把水压入量筒,量筒内水的体积就是二氧化碳的体积;故答案为:根据进入量筒内水的体积,测量生成的CO2的体积(或其他合理答案);
(5)读数时视线与凹液面的最低处保持水平,因此读数为165mL,即0.165L,二氧化碳的密度为2g•L-1,因此二氧化碳的质量为0.33g.
设碳酸钙的质量分数为x,则样品中碳酸钙的质量为3xg,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
3xg 3.3g
$\frac{100}{3xg}=\frac{44}{3.3g}$
x=25%
故答案为:165;25%;
(6)在实验过程中无法考虑盐酸加入后烧瓶内物质所占体积的变化对测定数据产生的影响,可能会对测定样品中R的质量分数产生一定的影响;
故答案为:无法考虑盐酸加入后烧瓶内物质所占体积的变化对测定数据产生的影响(或其他合理答案).
答案:
(1)CO2+Ca(OH)2═CaCO3↓+H2O;
(2)取少量上层清液,滴加 1~2 滴无色酚酞试液(或其他合理答案);溶液变成红色(或其他合理答案);
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑; 无气泡产生;
(4)根据进入量筒内水的体积,测量生成的 CO2的体积(或其他合理答案);
(5)165; 25%;
(6)无法考虑盐酸加入后烧瓶内物质所占体积的变化对测定数据产生的影响(或其他合理答案)
点评 本题从定性和定量的两个角度探究了氢氧化钙的变质程度及变质程度的计算,难度较大,解题的关键是明确氢氧化钙、碳酸钙等的性质及测定的原理.


科目:初中化学 来源: 题型:实验探究题
 在化学实验室,小明发现一瓶没有密封好的NaOH已经结块.
在化学实验室,小明发现一瓶没有密封好的NaOH已经结块.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
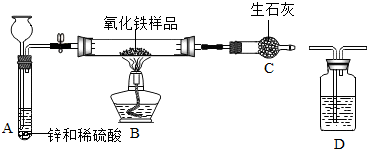
| 实验现象 | 化学方程式 |
| A中反应产生大量气泡; | A中:Zn+H2SO4═ZnSO4+H2↑. |
| B中红色粉末逐渐变黑色; | B中:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2. |
| 反应前 | 氧化铁完全反应后 | |
| ①组 | B:玻璃管质量32.4g,氧化铁样品的质量10.0g | B:玻璃管和管内固体物质的质量40.0g |
| ②组 | C:干燥管和生石灰质量40.Og | C:干燥管和管内固体物质的质量43.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| I.取少量溶液于试管中,向溶液中滴加足量的氯化钙溶液,并不断振荡. | 白色沉淀产生 | 猜想II正确,含有氢氧化钠和碳酸钠 |
| II.将步骤I反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液. | 酚酞试液变红色 |
| 温度(℃) | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度(g/100g水) | 64 | 85 | 138 | 203 | 285 | 376 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com