
| 食 物 | 苹 果 | 葡 萄 | 牛 奶 | 玉米粥 |
| pH | 2.9-3.3 | 3.5-4.5 | 6.3-6.6 | 6.8-8.0 |
| A. | 苹果 | B. | 葡萄 | C. | 牛奶 | D. | 玉米粥 |
分析 根据“当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性”进行分析.
解答 解:A、苹果的pH值为:2.9~3.3,小于7,呈酸性,不适合胃酸过多的人空腹食用,故A不正确;
B、葡萄的pH值为:3.5-4.5,小于7,呈酸性,不适合胃酸过多的人空腹食用,故B不正确;
C、牛奶的pH值为:6.3~6.6,小于7,呈酸性,不适合胃酸过多的人空腹食用,故C不正确;
D、玉米粥的pH值为:6.8~8.0,略大于7,呈弱碱性,胃酸过多的人,空腹时可以食用,故D正确.
故选D.
点评 解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系,只有这样才能对相关方面的问题做出正确的判断.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
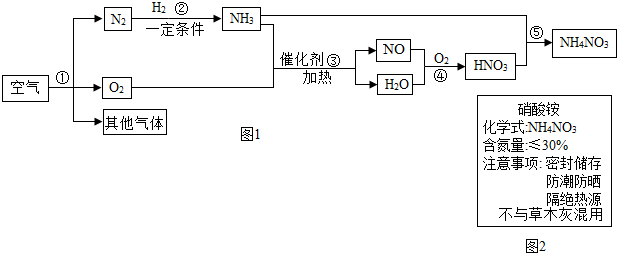
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
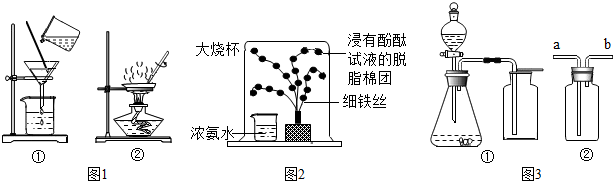
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO(CO2)--在足量的氧气中燃烧 | |
| B. | MnO2粉末(KCl)--溶解、过滤、洗涤、干燥 | |
| C. | FeSO4溶液(CuSO4)--加入足量锌粉、过滤 | |
| D. | NaCl晶体(Na2CO3)--加入适量稀硫酸蒸发结晶 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加入NaOH溶液的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 生成沉淀的质量/g | 0.0 | 0.00 | 2.45 | 4.90 | 4.90 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
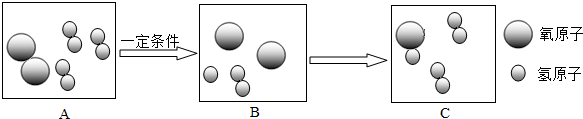
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
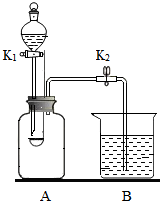 用如图所示装置进行实验.A的容积为350mL,装置气密性良好,实验前K1、K2均已关闭.
用如图所示装置进行实验.A的容积为350mL,装置气密性良好,实验前K1、K2均已关闭.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
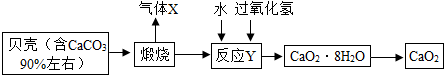
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com