
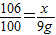 解得:x=9.54g,根据
解得:x=9.54g,根据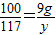 解得y=10.53g
解得y=10.53g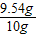 ×100%=95.4%
×100%=95.4% 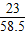 ×100%+9.54g×
×100%+9.54g×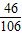 ×100%=8.46g,所以该工业纯碱样品中钠元素的质量分数:
×100%=8.46g,所以该工业纯碱样品中钠元素的质量分数: ×100%=84.6%.
×100%=84.6%.

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
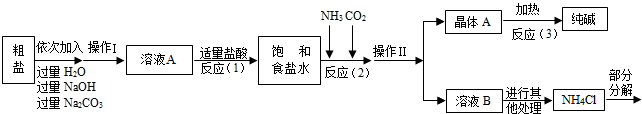
| 实验步骤 | 实验现象 | 实验结论 |
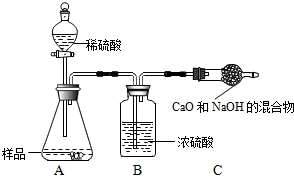
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
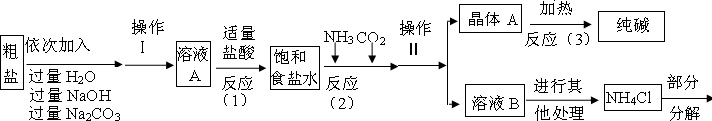
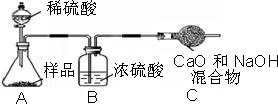 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||

| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||

| 实验步骤 | 实验现象 | 实验结论 |
取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管另一端伸入澄清石灰水中.加热固体并观察现象. 取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管另一端伸入澄清石灰水中.加热固体并观察现象. |
产生无色气泡,澄清石灰水变浑浊 产生无色气泡,澄清石灰水变浑浊 |
该样品是NaHCO3否则是Na2CO3 该样品是NaHCO3否则是Na2CO3 |
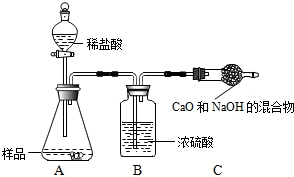
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com