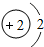²ÄĮĻ£ŗČĖĄąŅŖŌŚŌĀĒņ¾Ó×”£¬Ź×ĻČĄė²»æŖµĖ®ŗĶŃõĘų£¬¶ųŌĀĒņÉĻ¼ČƻӊĖ®ÓÖƻӊæÕĘų£®æĘѧ¼Ņ·¢ĻÖŌĀĒņµÄɳĶĮÖŠŗ¬ÓŠ·įø»µÄŗ¬ŃõīŃĢśæ󣬳ɷÖĪŖTiO
2ӢFe
2O
3µÄ»ģŗĻĪļ£¬Čō½«ÕāŠ©æóŹÆĄūÓĆCOĄ“»¹ŌæÉŅŌĢįĮ¶µ„ÖŹīŃŗĶĢś£¬ČōÓĆĒāĘų»¹Ō£¬æÉŅŌµĆµ½µĖ®£®Čō½«ÕāŠ©æóŹÆĶصē£¬»¹æÉŅŌ“ÓÖŠ·ÖĄė³öŃõĘų£®
£Ø1£©ŌĀĒņĶĮČĄÖŠ“ęŌŚĢģČ»µÄĢś”¢½š”¢Ņų”¢µČ¶ąÖÖ½šŹōæóĪļæÅĮ££®Čō“ÓĢś”¢½š£ØAu£©”¢Ņų»ģŗĻ½šŹōÖŠ»ŲŹÕijŠ©½šŹō£¬½«»ģŗĻ½šŹō·ÅČė×ćĮæµÄŃĪĖįÖŠ³ä·Ö·“Ó¦£¬Č»ŗó¹żĀĖ£¬Ź£ÓąµÄ¹ĢĢåÖŠæÉŅŌ»ŲŹÕµĆµ½µÄ½šŹō×éŗĻŹĒ
C
C
A£®Fe B£®Au”¢Fe C£®Ag”¢Au D£®Fe”¢Ag
£Ø2£©¾ŻæĘѧ¼ŅŌ¤²ā£¬ŌĀĒņµÄĶĮČĄÖŠĪüø½×Å°ŁĶņ¶ÖµÄŗ¤£ØHe-3£©£¬ĘäŌ×ÓŗĖÖŠÖŹ×ÓŹżĪŖ2”¢ÖŠ×ÓŹżĪŖ1£¬Ćæ°Ł¶Öŗ¤£ØHe-3£©ŗĖ¾Ū±äĖłŹĶ·ÅµÄÄÜĮæĻąµ±ÓŚÄæĒ°ČĖĄąŅ»ÄźĻūŗĵÄÄÜĮ森ĻĀĮŠ¹ŲÓŚŗ¤£ØHe-3£©ŌŖĖŲµÄĖµ·ØÕżČ·µÄŹĒ
D
D
A£®Ō×ÓŗĖĶāµē×ÓŹżĪŖ3 B£®Ļą¶ŌŌ×ÓÖŹĮæĪŖ2
C£®Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ
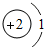
D£®Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ
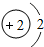
£Ø3£©”°ęĻ¶šŅ»ŗÅ”±·¢ÉäµÄ»š¼żĶĘ½ųĘ÷֊װӊŅŗĢ¬ėĀ£ØÓĆA±ķŹ¾£©ŗĶ¹żŃõ»ÆĒā£ØH
2O
2£©£¬ĖüĆĒ»ģŗĻŹ±µÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗ2H
2O
2+AØTN
2+4H
2O£¬ŌņėĀ£ØA£©µÄ»ÆѧŹ½ĪŖ
D
D
A£®N
2H
2 B£®N
2H
4O
2 C£®NH
2 D£®N
2H
4£Ø4£©“ÓĢśÉśŠāĢõ¼žĄ“·ÖĪö£¬ŌĀĒņÉĻĢśÖĘĘ·
²»Ņ×
²»Ņ×
£ØĢī”°Ņ×”±»ņ”°²»Ņ×”±£©ÉśŠā£¬ŌŅņŹĒ£ŗ
ŌĀĒņÉĻ¼ČƻӊĖ®ÓÖƻӊæÕĘų
ŌĀĒņÉĻ¼ČƻӊĖ®ÓÖƻӊæÕĘų
£®
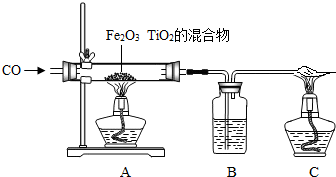
£Ø5£©ĻÖĄūÓĆCOĄ“»¹ŌTiO
2ӢFe
2O
3µÄ»ģŗĻĪļĢįĮ¶µ„ÖŹīŃŗĶĢś£¬×°ÖĆČēĶ¼ĖłŹ¾£¬ŹŌ»Ų“š£ŗ
¢ŁŠ“³öAÖŠ·¢Éś·“Ó¦»Æѧ·½³ĢŹ½£ØČĪŅāŅ»øö£©
£®
¢ŚÓĆCO»¹ŌīŃĢśæó£¬Éś³ÉīŃŗĶĢśµÄ»ģŗĻĪļ£¬æÉÓĆ¼ņµ„µÄĪļĄķ·½·Ø½«Į½ÖÖĪļÖŹ·ÖæŖ
ÓĆ“ÅĢśĪüŅżĢś·Ū
ÓĆ“ÅĢśĪüŅżĢś·Ū
£®
¢Ū¾ĶŹµŃé²Ł×÷Ė³ŠņµÄĪŹĢāĮ½Ī»Ķ¬Ń§³öĻÖĮĖ·ÖĘē£®Š”ŌĀČĻĪŖĻČĶØŅ»¶ĪŹ±¼äCOÅÅæÕ£¬Č»ŗóŌŁµćČ¼CŗĶAÖŠµÄ¾Ę¾«µĘ£¬Š”ĮĮČĻĪŖÕāŃł×ö²»ŗĆ£¬ĖūµÄĄķÓÉŹĒ
COÓŠ¾ē¶¾£¬¶ŌæÕĘųÓŠĪŪČ¾
COÓŠ¾ē¶¾£¬¶ŌæÕĘųÓŠĪŪČ¾
£»
Š”ĮĮČĻĪŖĻȵćČ¼CŗĶAÖŠµÄ¾Ę¾«µĘ£¬Č»ŗóŌŁĶØCO£¬Š”ŌĀÓÖĢį³ö·“¶Ō£¬ĖżµÄĄķÓÉŹĒ
COÓėČŻĘ÷ÄŚæÕĘų»ģŗĻ£¬µćČ¼ŗóæÉÄÜ»į·¢Éś±¬ÕØ
COÓėČŻĘ÷ÄŚæÕĘų»ģŗĻ£¬µćČ¼ŗóæÉÄÜ»į·¢Éś±¬ÕØ
£¬ĄĻŹ¦ČĻĪŖĖūĆĒµÄ·“¶ŌŅā¼ū¶¼ÓŠŅ»¶ØµĄĄķ£®ĒėÄć°ļÖśÕāĮ½Ī»Ķ¬Ń§½ā¾öĖūĆĒµÄĄ§ÄŃ£¬ÄćµÄ°ģ·ØŹĒ
ĻČĶØŅ»¶ĪŹ±¼äµŖĘų£¬Åž”²£Į§¹ÜÄŚæÕĘų£¬Č»ŗóŌŁµćČ¼¾Ę¾«µĘ
ĻČĶØŅ»¶ĪŹ±¼äµŖĘų£¬Åž”²£Į§¹ÜÄŚæÕĘų£¬Č»ŗóŌŁµćČ¼¾Ę¾«µĘ
£®
£Ø6£©ŌŚŃ§Ļ°ĮĖ½šŹōµÄŠŌÖŹŗ󣬻ÆѧŹµŃ銔×éĶ¬Ń§¶Ō”°21ŹĄ¼ĶµÄÖŲŅŖ½šŹō²ÄĮĻīŃŗĶīŃŗĻ½š”±²śÉśĮĖŠĖȤ£¬ĖūĆĒ½ųŠŠĮĖČēĻĀĢ½¾æ£¬²¢ĒėÄćŅ»Ķ¬²ĪÓė£®
²éŌÄ׏ĮĻ£ŗ
A£®īѵÄÓ²¶ČÓėøÖĢś²ī²»¶ą£¬¶ųĖüµÄÖŹĮæÖ»ÓŠĶ¬Ģå»żøÖĢśµÄŅ»°ė£¬īѵÄĆܶČĖäČ»±ČĀĮÉŌ“óŅ»µć£¬æÉĖüµÄÓ²¶ČČ“±ČĀĮ“óĮ½±¶£®
B£®īŃŹōÓŚ»ÆѧŠŌÖŹ±Č½Ļ»īĘĆµÄ½šŹō£¬µ«ŌŚ³£ĪĀĻĀīѵÄæ¹øÆŹ“ŠŌŗÜĒ森¼“Ź¹°ŃīŃ·ÅŌŚŗ£Ė®ÖŠŹżÄź£¬Č”³öŗóČŌ¹āĮĮČē³õ£®
C£®īŃŗĻ½šÓėČĖĢå¾ßÓŠŗÜŗƵĔ°ĻąČŻŠŌ”±£¬ŌŚČĖĢåÄŚÄܵÖæ¹·ÖĆŚĪļµÄøÆŹ“ĒŅĪŽ¶¾£®
»ī¶ÆÓėĢ½¾æ£ŗ
¢ŁīŃÓėĢśµÄ½šŹō»ī¶ÆŠŌÄÄŅ»ÖÖĒæ£æ
”¾Ģį³ö¼ŁÉč”æ£ŗ
īŃµÄ½šŹō»ī¶ÆŠŌ±ČĢśĒæ
īŃµÄ½šŹō»ī¶ÆŠŌ±ČĢśĒæ
£®
”¾Éč¼ĘŹµŃé”æ£ŗ
½«īŃ·ÅČėĮņĖįŃĒĢśČÜŅŗÖŠ£Ø»ņ½«ĢśŗĶīŃ·Ö±š·ÅČėĻ”ŃĪĖįÖŠ£»»ņ½«Ģś·ÅČėīѵĻÆŗĻĪļČÜŅŗÖŠ£©
½«īŃ·ÅČėĮņĖįŃĒĢśČÜŅŗÖŠ£Ø»ņ½«ĢśŗĶīŃ·Ö±š·ÅČėĻ”ŃĪĖįÖŠ£»»ņ½«Ģś·ÅČėīѵĻÆŗĻĪļČÜŅŗÖŠ£©
£®
ČōīѵĻī¶ÆŠŌ±ČĢśĒ棬ŅŌÉĻŹµŃé³öĻÖµÄĻÖĻóŹĒ£ŗ
īѵıķĆęÓŠŗŚÉ«ĪļÖŹÉś³É
īѵıķĆęÓŠŗŚÉ«ĪļÖŹÉś³É
£®
¢ŚīŃŹĒ±Č½Ļ»īĘĆµÄ½šŹō£¬ĪŖŹ²Ć“ÄĶøÆŹ“ŠŌČ“ŗÜĒæ£ææÉÄܵÄŌŅņŹĒ£ŗ
īѵıķĆęŅ׊Ī³ÉÖĀĆܵÄŃõ»ÆĪļ±£»¤Ä¤
īѵıķĆęŅ׊Ī³ÉÖĀĆܵÄŃõ»ÆĪļ±£»¤Ä¤
£®
¢ŪČōŅŖ±Č½ĻĀĮʬŗĶīŃʬµÄÓ²¶Č£¬ÄćµÄ·½·ØŹĒ£ŗ
æÉŅŌŹ¹ÓĆĮ½ÕßĻą»„æĢ»£¬³öĻÖŗŪ¼£µÄÓ²¶ČŠ”Ņ»Š©
æÉŅŌŹ¹ÓĆĮ½ÕßĻą»„æĢ»£¬³öĻÖŗŪ¼£µÄÓ²¶ČŠ”Ņ»Š©
£®
Ė¼æ¼ÓėÓ¦ÓĆ£ŗ
”°ĪļÖŹµÄŠŌÖŹŌŚŅ»¶Ø³Ģ¶ČÉĻ¾ö¶Ø×ÅĖüµÄÓĆĶ¾”±ĒėÄćÅŠ¶ĻīѵÄÓĆĶ¾£ØŠ“Į½Ģõ£©£ŗ
ÖĘČĖŌģ¹Ē£»·É»ś”¢·É“¬µČŗ½æÕ¹¤¾ß
ÖĘČĖŌģ¹Ē£»·É»ś”¢·É“¬µČŗ½æÕ¹¤¾ß
£®
£Ø7£©ČōŅ±Į¶2000tŗ¬ŌÓÖŹ3%µÄÉśĢś£¬ŠčŅŖŗ¬Fe
2O
376%µÄÉĻŹöŗ¬ŃõīŃĢśæóµÄÖŹĮæŹĒ¶ąÉŁ£æ£ØĒėŠ“³ö¼ĘĖć¹ż³Ģ£¬½į¹ū¾«Č·µ½0.1£®£©



 ĆūŠ£Į·æ¼¾ķĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
ĆūŠ£Į·æ¼¾ķĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø

 D£®Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ
D£®Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ