
| A. | 滴入适量 AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量 FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 滴入几滴酚酞试液,酚酞试液不变色 | |
| D. | 测得反应后溶液中 Na+与 Cl-的个数比为 1:1 |
分析 A、根据氯化物与硝酸银溶液反应生成不溶于硝酸的白色沉淀,进行分析判断.
B、根据滴入适量FeCl3溶液,但无沉淀生成,说明反应后无氢氧化钠,进行分析判断.
C、无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红.
D、根据氯化钠溶液中钠离子和离子的个数比为1:1,进行分析判断.
解答 解:A、氯化物与硝酸银溶液反应生成不溶于硝酸的白色沉淀,盐酸、氯化钠均能与硝酸银反应生成生成氯化银白色沉淀,不能证明两者恰好完全反应,故选项错误.
B、滴入适量FeCl3溶液,但无沉淀生成,说明反应后无氢氧化钠,但也可能是稀盐酸过量,不能证明两者恰好完全反应,故选项错误.
C、无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,滴入几滴酚酞试液,酚酞试液不变色,可能显中性,也可能是稀盐酸过量,不能证明两者恰好完全反应,故选项错误.
D、氯化钠溶液中钠离子和离子的个数比为1:1,测得反应后溶液中 Na+与 Cl-的个数比为1:1,能证明两者恰好完全反应,故选项说法正确.
故选:D.
点评 本题难度不大,掌握中和反应的原理、酸和碱的化学性质是正确解答本题的关键.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 构成金刚石、石墨、C60等碳单质的原子,其核内质子数都为6 | |
| B. | 未见饭菜就闻到饭菜的香味,说明物质的分子很小,且在不停地运动 | |
| C. | 某粒子的符号为Na+,表示的是一种金属阳离子 | |
| D. | 在化学变化中,原子的核电荷数和核外电子数都不发生改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子是保持物质性质的最小微粒 | |
| B. | 铝合金是纯净物 | |
| C. | 盐酸在通电时电离出氢离子和氯离子,其水溶液呈电中性 | |
| D. | 加到双氧水里的二氧化锰在反应前后质量和化学性质均不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫酸铜、食盐、石膏--盐 | B. | 熟石灰、纯碱、火碱--碱 | ||
| C. | 空气、碘酒、稀盐酸--混合物 | D. | 水、生石灰、氧化铜--氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 降低容器内的气压,使水的沸点低于80℃ | |
| B. | 缩短加热沸腾的时间 | |
| C. | 增加容器内的气压,使水的沸点低于80℃ | |
| D. | 用小火加热使其沸腾 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
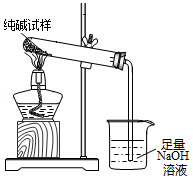 我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱.其生产过程用化学方程式可简要表示为:
我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱.其生产过程用化学方程式可简要表示为:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
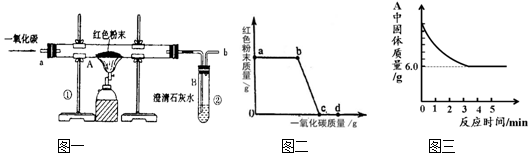
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
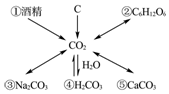
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com