
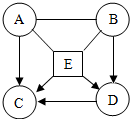
 已知A、B、C、D、E均为初中化学常见的酸、碱、盐.其中A为胃酸的主要成分,B是碱,C是生理盐水的组成成分,E在工业上广泛地应用于玻璃、造纸等的生产.将它们配成溶液后,存在如图所示的转化关系,已知A和E能反应产生气体,请回答下列问题(“-”表示相互间能反应,“→”表示在某种条件下能生成该物质):
已知A、B、C、D、E均为初中化学常见的酸、碱、盐.其中A为胃酸的主要成分,B是碱,C是生理盐水的组成成分,E在工业上广泛地应用于玻璃、造纸等的生产.将它们配成溶液后,存在如图所示的转化关系,已知A和E能反应产生气体,请回答下列问题(“-”表示相互间能反应,“→”表示在某种条件下能生成该物质):分析 根据A、B、C、D、E均为初中化学常见的酸、碱、盐,A为胃酸的主要成分,所以A是盐酸,C是生理盐水的组成成分,所以C是氯化钠,E是工业上广泛的应用于玻璃、造纸的生产,盐酸和E反应能产生气体,所以E是碳酸钠,碳酸钠会转化成D,D会转化成氯化钠,所以D可以是碳酸氢钠,B是碱,B可以是氢氧化钡,然后将推出的各种物质代入转化关系中验证即可.
解答 解:(1)A、B、C、D、E均为初中化学常见的酸、碱、盐,A为胃酸的主要成分,所以A是盐酸,C是生理盐水的组成成分,所以C是氯化钠,E是工业上广泛的应用于玻璃、造纸的生产,盐酸和E反应能产生气体,所以E是碳酸钠,碳酸钠会转化成D,D会转化成氯化钠,所以D可以是碳酸氢钠,B是碱,B可以是氢氧化钡,盐酸和氢氧化钠反应生成氯化钠和水,盐酸会与氢氧化钡反应生成氯化钡和水,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,氢氧化钡会与碳酸氢钠反应生成碳酸钡沉淀、氢氧化钠和水,碳酸钠和盐酸反应会生成氯化钠、水和二氧化碳,碳酸钠和水、二氧化碳反应会生成碳酸氢钠,碳酸氢钠和盐酸反应会生成氯化钠、水和二氧化碳,推出的各种物质均满足题中的转化关系,推导合理,所以A是HCl,E是Na2CO3;
(2)碳酸氢钠和氢氧化钡反应生成白色的碳酸钡沉淀、氢氧化钠和水,
化学方程式为:Ba(OH)2+NaHCO3═BaCO3↓+NaOH+H2O;
故答案为:
(1)HCl;Na2CO3;(2)Ba(OH)2+NaHCO3═BaCO3↓+NaOH+H2O;
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,推出的物质只要满足题中的转化关系即可,答案一般不是唯一的.


科目:初中化学 来源: 题型:实验探究题
 科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:
科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出耀 眼白光,无火星 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
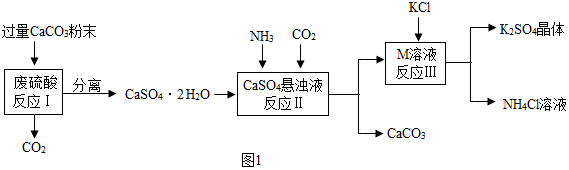
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com