
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:初中化学 来源: 题型:解答题
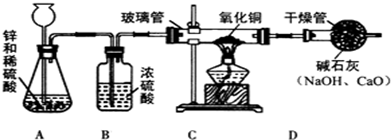
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
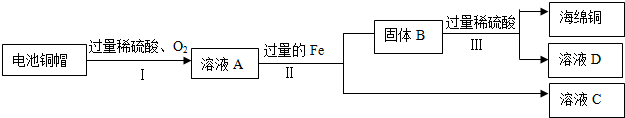
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
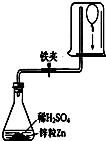 为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( ) | A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 18gMg、18gCu | B. | 20gCaO、20gCaCO3 | ||
| C. | 10gAgNO3溶液、5gCu(OH)2 | D. | 4gMg(OH)2、8.4gMgCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
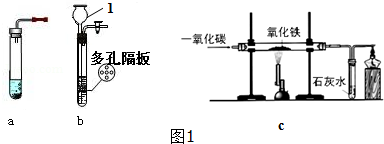 如图1所示装置制取氢气,试回答下列问题:
如图1所示装置制取氢气,试回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com