将20克硫酸钠和碳酸钠的混合物加入到200克稀硫酸中,恰好完全反应,放出气后,所得溶液的质量为215.6克.
求:
(1)CO2的质量;
(2)稀硫酸中硫酸的质量分数;
(3)反应后所得溶液中溶质的质量分数.
解:(1)根据化学反应可知,二氧化碳的质量等于质量的变化值,所以二氧化碳的质量=200+20-215.6=4.4克.
(2)设生成4.4克二氧化碳气体需要硫酸的质量是X,生成硫酸钠的质量为Y,需要碳酸钠的质量是Z.
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 98 142 44
Z X Y 4.4克
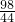
═
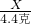
得:X=9.8克
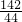
═

得:Y=14.2克
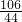
═
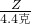
得:Z=10.6克
∴稀硫酸中硫酸的质量分数=
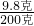
×100%═4.9%.
(3)根据(2)的计算,原混合物中硫酸钠的质量=20克-10.6克=9.4克;生成的硫酸钠的质量为14.2克.
反应后所得溶液中溶质的质量分数=

×100%═10.95%.
答:CO
2的质量为4.4克;稀硫酸中硫酸的质量分数为4.9%;反应后所得溶液中溶质的质量分数为10.95%.
分析:(1)根据化学反应可知,质量的变化是二氧化碳气体的放出导致的,也就是说二氧化碳的质量等于质量的变化值.
(2)根据二氧化碳的质量计算出硫酸的质量.
(3)反应后溶质有两部分:原有硫酸钠和生成的硫酸钠.
点评:本题的关键是知道质量的变化值等于二氧化碳的质量,注意(3)中溶质有两部分组成,即原有硫酸钠和生成的硫酸钠.

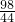 ═
═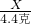
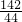 ═
═
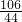 ═
═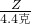
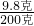 ×100%═4.9%.
×100%═4.9%. ×100%═10.95%.
×100%═10.95%.
