
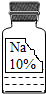
 实验室里有一瓶久置的无色溶液,因保管不当,其残缺的标签(如图所示).小兵和小芸同学很感兴趣,决定对其成分进行探究.
实验室里有一瓶久置的无色溶液,因保管不当,其残缺的标签(如图所示).小兵和小芸同学很感兴趣,决定对其成分进行探究.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/克 | 36 | 109 | 215 | 9.6 |
| 实验步骤 | 实验现象 | 结论或化学方程式 |
| 步骤1:取少量溶液于试管中, 滴加过量的硝酸钡溶液 | 产生沉淀 | 反应的化学方程式Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3 |
| 步骤2:静置、取上层清液于另一试管, 滴加氯化铁溶液 | 产生红褐色沉淀 | 原溶液为部分变质的氢氧化钠溶液 |
分析 查阅资料:Ⅱ.根据所给数据可以求出在20℃时各物质的饱和溶液的质量分数,可以做出判断
设计实验并继续探究:(1)氯化钠溶液呈中性,pH等于7
(2)根据碳酸钠可以和盐酸反应可以设计实验来验证碳酸钠的存在;
(3)利用碳酸钠、氢氧化钠性质差异及所设计实验中的现象,判断所采取的鉴别所用试剂、现象及结论;
【反思】根据久置的氢氧化钠变质的原因是与空气中的二氧化碳反应生成碳酸钠和水解答.
解答 解:【查阅资料】根据计算可以知道在20℃时饱和碳酸氢钠的质量分数为:$\frac{9.6g}{100g+9.6g}$×100%=8.8%,而题目中标注的溶液的质量分数为10%,所以能够排除碳酸氢钠,故本题答案为:NaHCO3;
【设计实验并继续探究】
(1)小兵用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,而氯化钠溶液呈中性,pH等于7所以不可能是氯化钠,故本题答案为:NaCl
(2)小兵为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:根据碳酸钠可以和盐酸反应可以设计实验来验证碳酸钠的存在,如果产生气泡,则说明是碳酸钠;
(3)根据碳酸钠能与硝酸钡反应白色碳酸钡沉淀,而与氢氧化钠不能反应而无明显现象,反应的化学方程式为:Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3;
静置、取上层清液于另一试管,滴加氯化铁溶液,氢氧化钠与氯化铁反应生成氢氧化铁红褐色沉淀,原溶液为部分变质的氢氧化钠溶液.
【反思】久置的氢氧化钠变质的原因是与空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O.
故答案为:
【查阅资料】NaHCO3
【设计实验并继续探究】(1)NaCl;
(2)产生大量的气泡;
(3)
| 实验步骤 | 实验现象 | 结论或化学方程式 |
| 步骤1:取少量溶液于试管中, 滴加过量的硝酸钡溶液 | 产生沉淀 | 反应的化学方程式 Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3 |
| 步骤2:静置、取上层清液于另一试管, 滴加氯化铁溶液 | 产生红褐色沉淀 | 原溶液为部分变质的氢氧化钠溶液 |
点评 本题综合利用了物质的组成、物质的溶解性、溶液的酸碱性及物质的变化规律对未知物质进行鉴别,体现运用化学知识分析问题、解决问题的能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
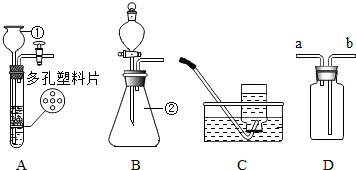 如图是实验室制取和收集气体的常见仪器.请回答下列问题.
如图是实验室制取和收集气体的常见仪器.请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe+O2=Fe3O4 化合反应 | |
| B. | 2H2O=2H2↑+O2↑ 分解反应 | |
| C. | Cu+2AgNO3=2Ag+Cu(NO3)2 置换反应 | |
| D. | Ba(OH)2+H2SO4=BaSO4↓+2H2O 中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶塞.对于该溶液是否变质,同学们开始实验探究.
某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶塞.对于该溶液是否变质,同学们开始实验探究.| 实验操作 | 可能出现的现象与结论 | 同学评价 | |
| 第1组 | 取少量样品溶液于试管中,向其中滴加酚酞试剂 | 若溶液变红,则猜想2不成立 | 第2组同学认为:此方案结论不正确,理由是:碳酸钠溶液呈碱性 . |
| 第2组 | 取少量样品溶液于试管中,向其中滴加足量的溶液CaCl2溶液 | 若产生白色沉淀,反应方程式是:Na2CO3+CaCl2═2NaCl+CaCO3↓, 则猜想(1)不成立 | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立 |
| 第3组 | 第一步:将第2组实验后的混合物过滤.第二步:取滤液于试管中,向其中滴加酚酞试剂 | 若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立. | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是: 实验结束后,让试管静置一段时间,取上层清液滴加酚酞溶液. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com