
用含
m g氢氧化钠的溶液恰好中和某强酸溶液,如改用含m g氢氧化钡的溶液来代替氢氧化钠,中和相同量的该强酸溶液,反应后溶液呈 ________性.科目:初中化学 来源: 题型:阅读理解
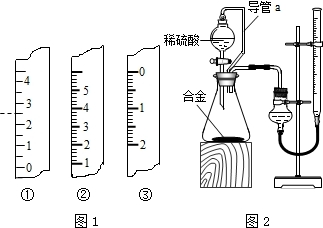
 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题:
| ||
. |
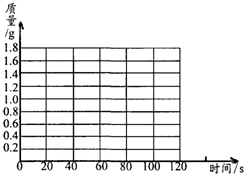
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题: NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:
NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省扬州中学九年级(下)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com