工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.
【原理思路】利用Na
2CO
3与稀H
2SO
4反应产生CO
2,通过CO
2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度.
【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略).
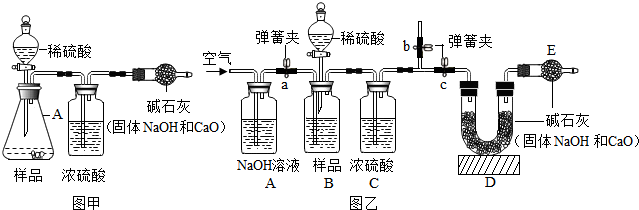
(1)A中发生反应的化学方程式为
.
(2)浓硫酸的作用为
.
【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差.你认为下列哪些因素会导致难以避免的误差
(填序号).
①加入的稀硫酸量不足 ②装置内空气中的CO
2没有排出
③反应产生的CO
2未被完全吸收 ④干燥管与空气直接相通
【方案改进】为减少误差,使CO
2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略).
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是
.
【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将
(填“偏高”、“偏低”或“无影响”).
【拓展提高】已知Na
2CO
3溶液滴加稀硫酸并不断振荡,先生成NaHCO
3,当Na
2CO
3全部转化为NaHCO
3后,生成的NaHCO
3能继续与稀硫酸反应生成CO
2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成为
.


