
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| KNO3 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
分析 Ⅰ、根据两种物质在40℃时的溶解度进行分析;
根据溶质质量分数的计算公式进行分析;
Ⅱ、根据硝酸钾的溶解度随温度的升高而增大进行分析;
Ⅲ、根据20℃时,氯化钠的溶解度进行分析;
Ⅳ、①根据氯化钠的溶解度受温度的影响变化较小进行分析;
②根据饱和溶液的判断方法,以及溶液中溶剂的质量进行分析.
解答 解:Ⅰ、在40℃时,氯化钠的溶解度是36.6克,硝酸钾的溶解度是63.9克,所以硝酸钾的溶解度大,该温度时KNO3饱和溶液的质量分数为:$\frac{63.9g}{100g+63.9g}$×100%;
Ⅱ、硝酸钾的溶解度随温度的升高而增大,所以将KNO3的不饱和溶液转化为饱和溶液的方法是降低温度;
Ⅲ、20℃时,氯化钠的溶解度是36克,所以将20g NaCl放入50g水中,所得溶液的质量是50g+18g=68g;
Ⅳ、①氯化钠的溶解度受温度的影响变化较小,所以从NaCl溶液中得到NaCl晶体的方法是蒸发结晶;
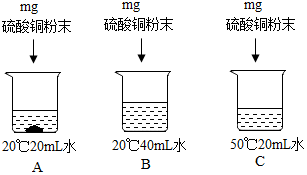
②通过分析可知,A烧杯底部有固体,所以一定属于饱和溶液的是A,B中的溶质是40mL,C中的溶剂是20mL,A中的硫酸铜会形成硫酸铜晶体,所以溶液中溶剂质量的大小关系是:B>C>A.
故答案为:Ⅰ、硝酸钾,$\frac{63.9g}{100g+63.9g}$×100%;
Ⅱ、降低温度;
Ⅲ、68g;
Ⅳ、①蒸发结晶;
②A,B>C>A.
点评 本题难度不大,掌握理解溶解度的概念、结晶的方法并能灵活运用是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 稀有气体通电发出有色光 | B. | 二氧化碳使澄清石灰水变浑浊 | ||
| C. | 氧气降温变成淡蓝色液体 | D. | 工业上分离液态空气制取氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 甲、乙两个实验小组利用如图装置(其中夹持装置已略去)探究二氧化碳与氢氧化钠溶液的反应.他们的实验步骤如下:
甲、乙两个实验小组利用如图装置(其中夹持装置已略去)探究二氧化碳与氢氧化钠溶液的反应.他们的实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 高炉炼铁中所需的高温和CO的生成都与焦炭有关 | |
| B. | 液氧可用于火箭发射,是因为氧气具有助燃性 | |
| C. | 碳酸氢铵与氢氧化钙混合使用,既可以增加肥效又可以改良酸性土壤 | |
| D. | 活性炭、Cl2、明矾都可以做净水剂,都可以杀菌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com