
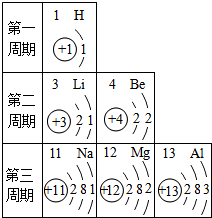
 根据给出的元素周期表中部分原子的结构示意图,回答问题.
根据给出的元素周期表中部分原子的结构示意图,回答问题.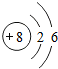 ,推测氧元素在元素周期表中应排在第二周期.
,推测氧元素在元素周期表中应排在第二周期. 分析 (1)根据原子序数=质子数来分析;
(2)根据原子结构示意图来分析;
(3)根据题意,元素在元素周期表中的周期数与其原子的核外电子层数相同,进行分析解答.
解答 解:(1)质子数为12,也就是原子序数为12,该元素是镁元素;故填:镁;
(2)由原子结构示意图可以看出,钠原子和锂原子的最外层均为1个电子,所以在化学反应中Na原子和Li原子都容易失去最外层的1个电子;故填:1;
(3)由氧原子结构示意图可知,氧原子的核外有2个电子层,则氧元素在元素周期表中应排在第2周期.故填:二.
点评 本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)、粒子结构示意图的含义是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 18 | 1 | 2 | 32 |
| 反应后质量/g | X | 26 | 2 | 12 |
| A. | 乙是反应物 | B. | 无法确定X的值 | ||
| C. | 该反应可能是复分解反应 | D. | 物质丙可能是该反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
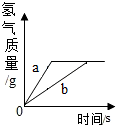 将等质量的锌和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )
将等质量的锌和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )| A. | a曲线表示锌 | B. | 反应消耗盐酸的总质量一定相等 | ||
| C. | 反应后盐酸一定没有剩余 | D. | 反应后锌一定有剩余 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
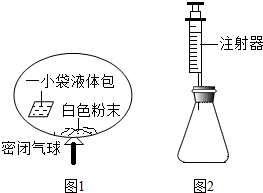 某研究小组对自动充气气球(示意图如图1)进行下列探究.
某研究小组对自动充气气球(示意图如图1)进行下列探究.| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0.10 | V1 |
| ② | 碳酸钠 | 0.10 | V2 |
| ③ | 白色粉末 | a | V1 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 装置 | B | C | D | E |
| 实验前质量/g | 160 | 150 | 150 | 100 |
| 实验后质量/g | 163.6 | 150 | 163.2 | 100 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 、H-O-、-O-O-”等几种,你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是-O-O-.以上是运用已有知识进行的推理,推理是否正确,需要通过实验进行验证.
、H-O-、-O-O-”等几种,你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是-O-O-.以上是运用已有知识进行的推理,推理是否正确,需要通过实验进行验证.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 10mL酒精和10mL水混合后体积小于20mL,是因为分子变小了 | |
| B. | 空气中含量最多的气体是氮气 | |
| C. | 生活中常用煮沸的方法将硬水转化为软水 | |
| D. | 扑灭森林火灾时,可开挖防火隔离带,其目的是隔离可燃物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com