
铁是生产、生活中应用广泛的金属材料.
(1)酸菜等酸性的食物不宜用铁质器具长期盛放,因为 .
(2)为减缓海水对铁质海轮外壳的腐蚀,制造海轮时,会在海轮船底四周镶嵌比铁更活泼的金属.下列金属适宜船底镶嵌的是 (填选项).
A.Pb(铅) B.Cu C.Pt(铂) D.Zn
(3)对铁“发蓝”处理,其表面将形成致密氧化膜而有效避免腐蚀.
①致密氧化膜能有效阻止铁锈蚀的原因是 .
②“发蓝”过程的化学方程式如下,式中X的化学式为 .
36Fe+4NaNO2+9NaNO3+26H2O=12X+13NaOH+13NH3↑
③为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质.由此可知该零件“发蓝”处理效果 (填“好”或“不好”),因为 (用化学方程式表示).
答案 解:(1)铁的活动性在H的前面,能与酸反应,所以酸菜等酸性的食物不宜用铁质器具长期盛放;
(2)根据金属活动性顺序,五种金属的活动性强弱关系为锌>铁>铅>铜>铂,根据分析,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是锌板;
(3)①经“发蓝”处理后的钢铁零件表面上的蓝黑色氧化膜能够使铁与水或氧气隔绝,从而避免(减缓)钢铁腐蚀.
②根据质量守恒定律,反应前后原子的种类和数目不变,反应前:Fe原子数目为36,Na原子的数目为13,N原子的数目为13,O原子的数目为57,H原子的数目为52;反应后:Fe原子数目为0,Na原子的数目为13,N原子的数目为13,O原子的数目为13,H原子的数目为52;所以,X的化学式为Fe3O4
③如果氧化膜不致密,裸露出来的铁与硫酸铜的反应生成了铜和硫酸亚铁,反应的方程式为Fe+CuSO4 ═FeSO4 +Cu.
故答案为:(1)铁会与酸反应而使铁质器具被腐蚀;
(2)D;
(3)①致密的氧化膜使铁与氧气(或空气)和水隔绝;
②Fe3O4;
③不好;Fe+CuSO4=Cu+FeSO4.


科目:初中化学 来源: 题型:
2014年很多明星因为吸毒而锒铛入狱,饱受公众指责。冰毒(C10H15N)是一 种常见的毒品。以下说法正确的是( )
A.冰毒分子由三种元素组成 B.冰毒由26个原子构成
C.冰毒中碳元素的质量分数最高 D.冰毒的相对分子质量为149g
查看答案和解析>>
科目:初中化学 来源: 题型:
有科学家预言,氢能将成为21世纪的主要能源,但除了先要解决制备氢气的能耗问题之外,还必须解决的问题是( )
A.原料受到限制 B.造成环境污染
C.储存和运输不便 D.氢气燃烧放出的热量少
查看答案和解析>>
科目:初中化学 来源: 题型:
金属材料在国防建设中起着重要的作用,图1为歼﹣15飞机在航空母舰上起飞.

图1 图2
图2
(1)国防建设中大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如铝合金比纯铝的硬度 (填“大”或“小”).
(2)日常生活中铝制品比铁更耐腐蚀的原因是 (用化学方程式表示).
(3)钢铁的锈蚀主要是铁与空气中的 、 共同作用的结果.
(4)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是  .
.
②实验二若出现 现象,可证明铁的活动性强于铜.
(5)某兴趣小组对一份含铁的固体样品进行探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6g固体样品,用图3所示的装置实验,测定的数据如图4所示.
①图3中硬质玻璃管中的生成铁的化学方程式为 .
②固体样品中氧化铁的质量是 克.
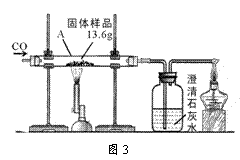
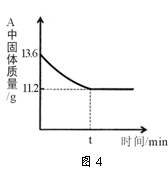
③将上述反应后11.2g的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数 (结果精确到0.1%)(不写计算过程).
查看答案和解析>>
科目:初中化学 来源: 题型:
由钛铁矿(主要成分是FeO和TiO2的混合物)提取金属钛(化学式为Ti)的主要 工艺流程如下:
工艺流程如下:
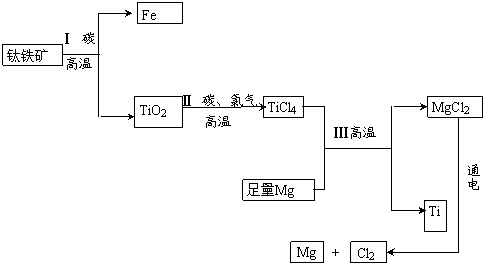
(1)上述流程中的物质属于氧化物的是 (填一种化学式即可),属于非金属单质的是 (填一种化学式即可),TiO2中钛元素的化合价是 。
(2)步骤Ⅰ中FeO和碳反应生成二氧化碳和铁,反应的符号表达式是 。
(3)该流程中可循环 利用的物质是 。
利用的物质是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:
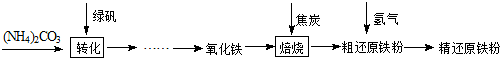
FexOy+yH2 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为: .
3Fe+CH4粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为: .
(1)写出焙烧中氧化铁与CO反应的化学方程式 .
(2)焙烧中加焦炭的作用除了可以作燃料提供反应所需高温外,还能 .
【含量测定】甲同学为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.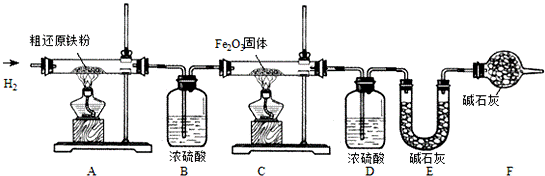
已知:3CH4+4Fe2O3 3CO2+6H2O+8Fe,浓硫酸有吸水性,碱石灰不仅能吸收水而且能吸收CO2.(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响).
3CO2+6H2O+8Fe,浓硫酸有吸水性,碱石灰不仅能吸收水而且能吸收CO2.(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响).
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃C处酒精灯;
④点燃A 处酒精灯;
⑤分别熄灭A、C处酒精灯;
⑥ ;
⑦再次称量必要装置的质量.
(4)步骤②的目的是 ,验证该步骤目的达到的实验方法是 .
(5)反应后C装置中的现象是 .
(6)装置F的作用是 .
(7)若缺少装置D,则所测氧元素的质量分数将 (“偏大”、“偏小”或“不变”).
(8)实验后,甲同学根据装置 (填A、B、C、D、E、F)的增重分别算得样品中氧和碳元素的质量分数.
(9)乙同学将10.0克粗还原铁粉样品与足量稀盐酸充分反应,经测定共产生0.3克气体.计算该粗还原铁粉样品中铁单质的质量分数.(要求写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
首辆会飞的汽车在荷兰问世,该车空中时速可达190公里,加满油后一次最远可飞行约550公里,价格跟豪华轿车差不多,请回答下列问题:
(1)会飞的汽车壳体材料可以是 ;(在A.B、C中选填)
A.韧性好、硬度大的锰钢
B.强度好、密度小的铝合金
C.抗腐蚀性好的不锈钢
(2)会飞的汽车工作过程中的能量转化为 ;
(3)会飞的汽车工作时产生的尾气中含有一氧化氮,对空气会造成污染,可利用氨气在400℃和有催化剂的条件下将其转化为空气中含量最多的一种气体和生活中常见的一种液体.则发生化学反应的方程式是 ,该反应的反应物中氮元素的化合价分别为 .
(4)有人提出用太阳能电池做汽车的动力来源,如果可行,与使用汽油为动力的汽车相比,不仅减少了尾气中 的排放(两种即可),还可以节约 .

查看答案和解析>>
科目:初中化学 来源: 题型:
某化肥包装袋上的部分说明如图所示。
| 硝酸铵 化学式:NH4NO3 净重:50 kg 含氮量:≥30% 注意事项:密封贮存 防潮防晒 隔绝热源 |
(1)硝酸铵属化学肥料中的 (填序号)。
A.钾肥 B.氮肥 C.磷肥
(2)硝酸铵应具有的性质是 (填序号)。
A.易溶于水 B.有挥发性 C.受热易分解
(3)硝酸铵能与强碱反应,其中与烧碱反应的方程式为
NH4NO3+NaOH====NaNO3+NH3↑+X,
则X的化学式是 ;施用该类肥料时,要避免与 (填“酸”或“碱”)性物质混用,否则会降低肥效。
查看答案和解析>>
科目:初中化学 来源: 题型:
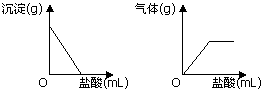 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如下图所示。由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如下图所示。由此推断白色固体中( )
A.可能存在NaOH
B.可能存在Na2SO4
C.肯定不存在BaCl2
D.肯定只存在Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com