
| 测试地段 | 校园绿苑 | 保持通风的刚下课的教室 | 门窗紧闭的刚下课的教室 | 校园运动场 | 校门外交通主干道边 |
| 抽气次数 | 13 | 11 | 7 | 12 | 5 |


科目:初中化学 来源: 题型:
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| ①取食品包装袋中的“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣. | 无 | 无 |
| ②取步骤①中的滤渣8.0 g,加入足量② |
若没有气泡产生. | 证明固体① |
| 若③ |
证明固体肯定含有④ | |
| ③取步骤②中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0 g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3) | 无 | 确认固体含有⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
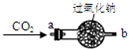
| 实 验 操 作 | 实 验 现 象 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生, 石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 室温下,将大小相同并打磨光亮的铬片、铝片、铜片分别投入盛有体积相同、 溶质质量分数 溶质质量分数 相同的稀硫酸的试管中 |
铬片表面产生气泡缓慢 铝片表面产生气泡较快 铜片表面 无现象 无现象 |
猜想 ③ ③ (填序号)成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 验实号编 | 试剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 取少量该瓶的氢氧化钠溶液于试管中,加入适量 |
该氢氧化钠溶液已经变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com