
���� �������������Ϸ���ʽ��������SO2��������������Һ������=��Ʒ����+ϡ��������-��������-SO2��������
��� �⣺��1��������SO2������Ϊx��
Na2S2O3+H2SO4�TNa2SO4+H2O+S��+SO2��
32 64
3.2g x
$\frac{32}{3.2g}$=$\frac{64}{x}$
x=6.4g
��2��������Һ������=16g+113.6g-3.2g-6.4g=120g
�ʴ�Ϊ����1��6.4 g����2��120 g��
���� ����Ϊ���ݻ�ѧ���̼���Ļ������ͣ�����Ҫ�����д��ʽ����������ȷ����Ӱ�챾������أ�


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���ʣ�������Ϊ���ʣ� | �Լ� | �������� |
| A | FeSO4��Һ��CuSO4�� | ����п�� | ���� |
| B | CO2���壨CO�� | �������� | ��ȼ |
| C | NaCl���壨Na2CO3�� | ����ϡ���� | ���� |
| D | CaO���壨CaCO3�� | ������ˮ | ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
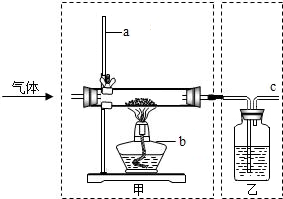 ������ͼ��ʾ��װ�ã��ɽ����������ʵ�̽��ʵ�飮�IJ�������ʢ�ź�ɫ��ĩ��CuO��C�����ҵ�ϴ��ƿ��ʢ����ɫ��Һ[����ʯ��ˮ��NaOH��Һ��NaOH�Ļ�ѧ������Ca��OH��2���ƣ�������CO2��Ӧ]��
������ͼ��ʾ��װ�ã��ɽ����������ʵ�̽��ʵ�飮�IJ�������ʢ�ź�ɫ��ĩ��CuO��C�����ҵ�ϴ��ƿ��ʢ����ɫ��Һ[����ʯ��ˮ��NaOH��Һ��NaOH�Ļ�ѧ������Ca��OH��2���ƣ�������CO2��Ӧ]��| ʵ������ | �� | �� |
| ʵ��һ ̽��CO��CuO�ķ�Ӧ | ��Ӧ�Ļ�ѧ����ʽΪ�� CO+CuO $\frac{\underline{\;\;��\;\;}}{\;}$CO2+Cu | ����ʯ��ˮ�������ǣ� �����Ƿ���CO2������� |
| ʵ�����b���ɾƾ���ƣ� ̽��CO2��C�ķ�Ӧ | ��Ӧ�Ļ�ѧ����ʽΪ�� CO2+C $\frac{\underline{\;����\;}}{\;}$2CO | NaOH��Һ�������ǣ� ��ȥ�������գ�CO2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
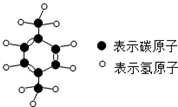 ���գ��廪ѧ�Ӳ�η�������۵�ѹ���������ˡ�PX���Ͷ��Ŀ�ѧ���࣮PX����ɫ��Һ�壬���з�����ζ�������Ҵ����л��ܼ����ܣ���ȼ���Ͷ��������Ը����Ҵ�����������������γɱ�ը�Ի�����ͼ�ǡ�PX���Ľṹģ�ͣ������йء�PX����˵������ȷ���ǣ�������
���գ��廪ѧ�Ӳ�η�������۵�ѹ���������ˡ�PX���Ͷ��Ŀ�ѧ���࣮PX����ɫ��Һ�壬���з�����ζ�������Ҵ����л��ܼ����ܣ���ȼ���Ͷ��������Ը����Ҵ�����������������γɱ�ը�Ի�����ͼ�ǡ�PX���Ľṹģ�ͣ������йء�PX����˵������ȷ���ǣ�������| A�� | һ����PX����������18��ԭ�Ӻ� | |
| B�� | ��PX����ȼ�����з�����ζ���Ͷ����������Ļ�ѧ���� | |
| C�� | ��PX����C��H����Ԫ�ص�������Ϊ4��5 | |
| D�� | ��PX���Ļ�ѧʽΪC8H10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X����Һ | Y����Һ | Z����Һ | |
| Ni | �� | �� | �� |
| Mn | �� | �� | �� |
| A�� | X Mn Y Ni Z | B�� | Z Ni Y Mn X | ||
| C�� | Z Mn Y Ni X | D�� | X Mn Ni Y Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȼ������ˮ�Ͷ�����̼ | B�� | ��ɫ | ||
| C�� | ������ˮ | D�� | ��ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��һ�� | �ڶ��� | ������ | ���Ĵ� | |
| ����ϡ��������� | 10g | 10g | 10g | 10g |
| ʣ���������� | 9.10g | 8.45g | 7.80g | 7.80g |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com