


科目:初中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
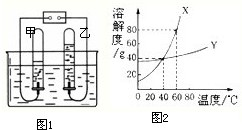 水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:
水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:| 感官指标 | 化学指标 | 细菌指标 |
| 水质无色无味澄清 | pH:6.5~8.5 | 细菌总个数<100个/mL等 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
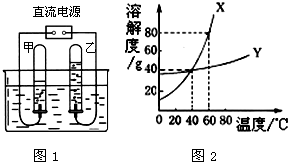 水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:
水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:| 感官指标 | 化学指标 | 细菌指标 |
| 水质无色无味澄清 | PH:6.5~8.5 | 细菌总个数<100个/mL等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
查看答案和解析>>
科目:初中化学 来源:2009年江苏省苏州市常熟市中考化学调研试卷(解析版) 题型:解答题
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com