
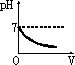
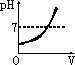
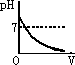
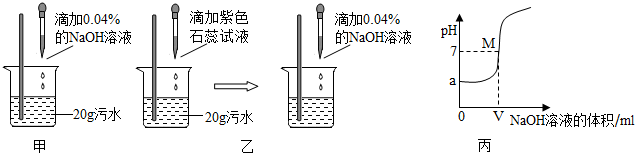
在甲溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加乙溶液,当滴至溶液呈紫色时,再继续滴加乙溶液时,溶液呈红色.在上述过程中,表示溶液的pH(纵坐标)与滴加乙溶液的体积V(横坐标)之间的关系的正确图象是
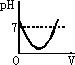
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
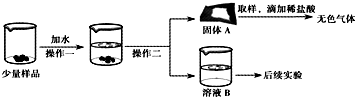 CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:
CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 |
① 有白色沉淀生成 有白色沉淀生成 ② 溶液由无色变为红色 溶液由无色变为红色 |
猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
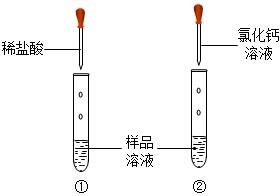 (2013?松北区二模)化学课外小组的同学以“氢氧化钠变质程度”为课题,进行科学探究活动,请根据己学知识完成下列探究问题.
(2013?松北区二模)化学课外小组的同学以“氢氧化钠变质程度”为课题,进行科学探究活动,请根据己学知识完成下列探究问题.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
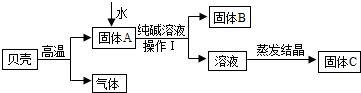
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 猜想成立 | |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的 |
猜想成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com