
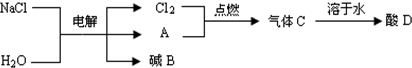
分析 (1)根据节约原料,方法可行的角度进行分析;
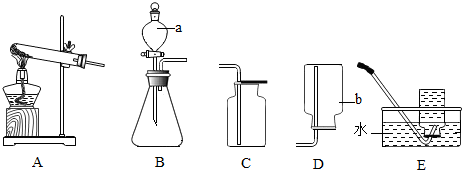
(2)根据粗盐提纯的步骤是:称量、溶解、过滤、蒸发、再次称量、计算产率;在蒸发操作中使用到玻璃棒搅拌;实验结束后称量获得的精盐,并计算精盐的产率,发现产率较低,根据计算公式可以知道最后所得到精盐少了,或是粗盐的质量多了,或是计算错误等原因进行分析;
(3)根据除掉杂质时一定不能引入新的杂质,并结合酸碱盐之间的反应规律进行分析;
(4)①根据密度最小的气体是氢气,氯气和氢气点燃时生成氯化氢气体,溶于水生成盐酸,并放出热量,结合置换反应的定义进行分析;
②根据质量守恒定律,化学反应前后元素种类不变进行分析.
解答 解:(1)三种方式中甲需要大量的石灰乳,乙则需要加热消耗能量,只有丙的方式节约原料和能源且可行;
(2)在蒸发操作中使用到玻璃棒,作用是:搅拌,使之受热均匀,防止液滴飞溅;
A、粗盐未充分溶解就过滤,导致溶液中氯化钠质量偏小,所以产率偏低,故A正确;
B、倾倒时,有部分氯化钠溶液溅出,导致氯化钠溶液偏小,所以产率偏低,故B正确;
C、蒸发后,所得的精盐较潮湿,氯化钠固体质量偏大,产率偏大,故C错误;
故选:AB;
(3)从除杂的原理出发可知,当粗盐中含有硫酸钠、氯化钙等杂质时一般是先加入过量的氢氧化钡,以除掉溶液中的硫酸根离子(与钡离子结合成硫酸钡沉淀),再加入过量的碳酸钠,以除掉溶液中的钙离子(与碳酸根结合成碳酸钙)和剩余的钡离子(与碳酸根结合成碳酸钡沉淀),此时溶液中的杂质离子是多余的碳酸根离子和氢氧根离子,所以此时加入盐酸调节溶液的pH为7,即可除掉碳酸根离子和氢氧根离子;
(4)①密度最小的气体是氢气;氯气和氢气点燃时生成氯化氢气体,化学方程式为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,溶于水生成盐酸,并放出热量,铝和盐酸反应生成氯化铝和氢气,化学方程式为:2Al+6HCl═2AlCl3+3H2↑,铝和盐酸的反应满足单质与化合物反应生成单质与化合物的条件,所以该反应是置换反应,反应放出热量;
②根据质量守恒定律,在化学反应前后元素种类不变,可知碱B的化学式为NaOH.
故答案为:(1)丙;
(2)搅拌,防止局部温度过高,造成液滴飞溅,AB;
(3)氯化钡,稀盐酸;
(4)①H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,2Al+6HCl═2AlCl3+3H2↑,放出;
②质量守恒定律,NaOH.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转换关系推导剩余的物质,最后再结合题中的转化关系验证即可.


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
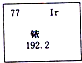 放射性元素依一 192可用于工业中无损探伤.如图是元素周期表中关于铱元素的信息,下列说法中错误的是( )
放射性元素依一 192可用于工业中无损探伤.如图是元素周期表中关于铱元素的信息,下列说法中错误的是( )| A. | 相对原子质量为192.2 | B. | 原子核外有77个电子 | ||
| C. | 原子核内有77个中子 | D. | 铱元素是金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
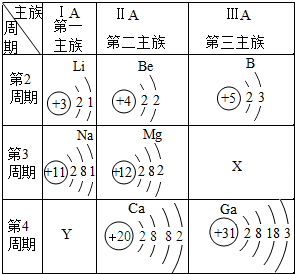 (1)根据表1中相关信息,回答下列问题:
(1)根据表1中相关信息,回答下列问题:| 物质 | 甲 | 乙 | 丙 | 丁 | 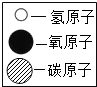 |
| 分子示意图 |  |  |  |  |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭:产生绿色火焰 | |
| B. | 红磷:产生大量白雾 | |
| C. | 镁带:产生黑色固体 | |
| D. | 铁丝:剧烈燃烧,火星四射,生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
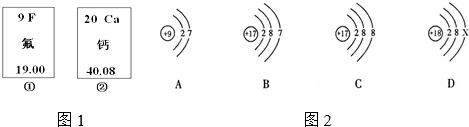
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的相对分子质量为280 | |
| C. | 青蒿素中C、H、0三种元素的质量比为90:11:40 | |
| D. | 青蒿素是由l5个碳原子、22个氢原子和5个氧原子构成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com