
(12分)实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气。
(1)查阅资料。
20℃时不同质量分数硫酸的密度(g/mL)
|
质量 分数 |
0% (纯水) |
1% |
4% |
10% |
16% |
24% |
32% |
36% |
44% |
49% |
60% |
98% |
|
密度 |
1.00 |
1.01 |
1.02 |
1.07 |
1.11 |
1.17 |
1.24 |
1.27 |
1.34 |
1.39 |
1.50 |
1.84 |
分析以上数据,可以得出结论(写2条)
① ;
② ;
(2)计算。配制200g24.5%的稀硫酸,需 g98%浓硫酸和 g水。实际操作时,取98%浓硫酸 mL(精确到1mL);
(3)配制稀硫酸。分别用量筒量取所需水和浓硫酸,先将 倒入烧杯中,然后
;
(4)制取氢气。
①下图中可用于制取、收集氢气的装置是(填字母) ;
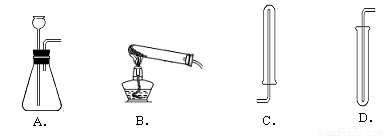
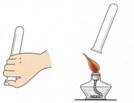
②检验氢气纯度的方法如图所示,标明氢气不纯的现象是 。
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:初中化学 来源: 题型:阅读理解
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2(2 Na2CO3?3 H2O2 )=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解;Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程. 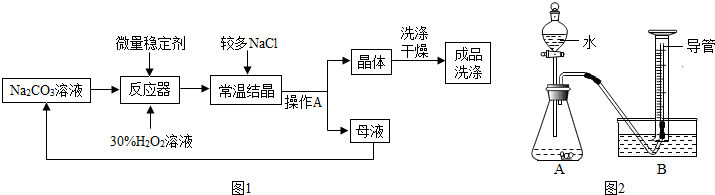 请回答问题: (1)反应器中发生反应的化学方程式为 2Na2CO3+3H2O2═2Na2CO3?3H2O2 2Na2CO3+3H2O2═2Na2CO3?3H2O2 ;(2)生产中,反应及干燥均需在较低温度下进行,原因是 防止过碳酸钠分解,影响产量和产率 防止过碳酸钠分解,影响产量和产率 ;(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 .(4)操作A的名称是 过滤 过滤 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒 玻璃棒 和漏斗 漏斗 ;(5)洗涤过碳酸钠晶体最好选用 B B .A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液 (6)母液可以循环使用,其中主要含有的溶质是 NaCl NaCl 和Na2CO3(或H2O2) Na2CO3(或H2O2) ;Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数. 小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验. [实验步骤]:① 检查气密性 检查气密性 ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中不再产生气体 不再产生气体 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.[实验分析及数据处理]: (7)完善实验步骤的相关内容:① 检查气密性 检查气密性 、④不再产生气体 不再产生气体 ;(8)实验中,水的作用是 溶解过碳酸钠,利于其分解 溶解过碳酸钠,利于其分解 ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是MnO2(或CuO) MnO2(或CuO) (填化学式);(9)实验中, A A ,则开始收集气体;A.刚开始出现气泡时 B.当气泡均匀连续出现时 C.若用带火星木条放在导管口部,复燃时 (10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g?L-1.),计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr(2Na2CO3?3H2O2)=314、Mr(O2)=32] 95% 95% ;[实验反思]: (11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 ;(12)量筒中长导管的作用是 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) ;(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由. 不正确,装置中原有空气和生成的O2等体积代换 不正确,装置中原有空气和生成的O2等体积代换 ;(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为 93.6% 93.6% .(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数? 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 .(只需给出简要的方案)
查看答案和解析>> 科目:初中化学 来源: 题型:阅读理解  小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验. 小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.【第一组实验】检验该双氧水是否失效. (1)实验过程 ①在试管中加入5mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃; ②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃; ③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 使氧气中的水蒸气冷凝(或除去氧气中的水蒸气) 使氧气中的水蒸气冷凝(或除去氧气中的水蒸气) .(2)实验结论: 双氧水没有失效 双氧水没有失效 .【第二组实验探究】:氧化铜(CuO)能否催化“双氧水”分解 [猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变; Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变; Ⅲ.CuO是反应的催化剂,反应前后 质量和化学性质不变 质量和化学性质不变 .[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:  (3)完成下表:
放热 放热 (选填“放热”或“吸热”).(5)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、 玻璃棒 玻璃棒 .(6)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 D D (填序号).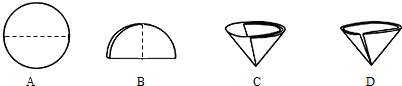 (7)步骤⑦的目的 检验氧化铜化学性质是否改变(或能否再催化过氧化氢分解) 检验氧化铜化学性质是否改变(或能否再催化过氧化氢分解) (8)过氧化氢能被CuO催化分解放出O2的反应表达式为 H2O2
H2O2 .
【第三组实验探究】:不同种类催化剂能否改变“双氧水”分解出氧气的量 [实验]分别选用二氧化锰与氧化铜,采用如图试剂与装置实验,测量所得氧气的体积.  (9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差不变 不变 (填“变大”、“变小”或“不变”),说明气密性良好. (10)使用冷水冷凝的目的是 使产生的氧气冷却到室温(或除去氧气中的水蒸气) 使产生的氧气冷却到室温(或除去氧气中的水蒸气) .反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数前,还需要进行的操作是移动水准瓶,使两边水面相平 移动水准瓶,使两边水面相平 .(11)两次实验表明,使用不同催化剂在常温下测得量气管读数均为112.0mL(O2的密度为1.43g/L),则实验中选用的量气管规格合适的是 B B (填字母序号). A.100mL B.200mL C.500mL (12)[实验结论]:不同种类的催化剂 不能 不能 改变双氧水分解出氧气的量.【拓展研究】查阅资料得知实验所取5mL 6%双氧水中含过氧化氢(H2O2)0.34g.请计算说明过氧化氢中的氧元素是否全部转化为氧气.(请写出计算过程,4分) 查看答案和解析>> 科目:初中化学 来源:2011年初中毕业升学考试(湖北随州卷)化学部分 题型:填空题 (9分)从C、H、O、N、S、P、Na、Ca、Fe、Mn、K、Cu等12种元素中选择恰当的元素,用离子符号、化学式或化学方程式按下列要求填空: (1)铵根离子 ;磷酸氢钙中的阴离子 ;能造成温室效应的气体单质 ;红色颜料铁红的主要成分 ;有毒的工业用盐亚硝酸钠 。 (2)细铁丝在氧气中燃烧 。 (3)实验室加热紫黑色晶体制取氧气 。 (4)除去硫酸亚铁溶液中的硫酸铜 。 (5)乙醇燃烧 。
查看答案和解析>> 科目:初中化学 来源:不详 题型:问答题 小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验. 【第一组实验】检验该双氧水是否失效. (1)实验过程 ①在试管中加入5mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃; ②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃; ③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是______. (2)实验结论:______. 【第二组实验探究】:氧化铜(CuO)能否催化“双氧水”分解 [猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变; Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变; Ⅲ.CuO是反应的催化剂,反应前后______. [实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验: 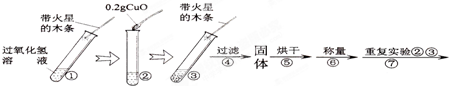 (3)完成下表:
(5)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、______. (6)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号). 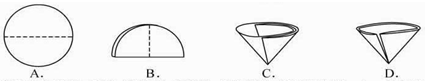 (7)步骤⑦的目的______ (8)过氧化氢能被CuO催化分解放出O2的反应表达式为______. 【第三组实验探究】:不同种类催化剂能否改变“双氧水”分解出氧气的量 [实验]分别选用二氧化锰与氧化铜,采用如图试剂与装置实验,测量所得氧气的体积. 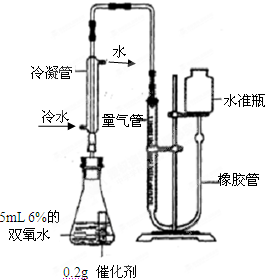 (9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______ (填“变大”、“变小”或“不变”),说明气密性良好. (10)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数前,还需要进行的操作是______. (11)两次实验表明,使用不同催化剂在常温下测得量气管读数均为112.0mL(O2的密度为1.43g/L),则实验中选用的量气管规格合适的是______ (填字母序号). A.100mL B.200mL C.500mL (12)[实验结论]:不同种类的催化剂______改变双氧水分解出氧气的量. 【拓展研究】查阅资料得知实验所取5mL 6%双氧水中含过氧化氢(H2O2)0.34g.请计算说明过氧化氢中的氧元素是否全部转化为氧气.(请写出计算过程,4分) 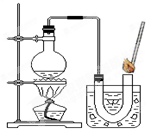 查看答案和解析>> 科目:初中化学 来源: 题型: 科学探究是奇妙的过程,某同学在进行实验探究时,向一种无色液体中加入一种白色块状固体,立即产生一种无色无味的气 ①此气体是什么物质?验证它的实验方案如下:
②产生此气体的化学方程式是 (4) 。可用 (5) 法收集该气体。 ③该同学想制取该气体,现提供制取和收集该气体的装置如图所示,请你帮他选择。
A.写出编号所指仪器的名称:a (6) b (7) 。 B.若要制取并收集该气体,应采用的发生装置、收集装置分别是 (8) 、 (9) (填序号)。利用该发生装置实验室还可以制取 (10) 气体。 C.若用图F收集该气体,气体应从 (11) 端(填“c”或“d”)导人。 ④该同学想进一步研究该气体的性质。用烧瓶收集满该气体,烧瓶用带导管(导管一端绑有一个气球)的橡皮塞塞紧。如图所示,挤捏胶头滴管,使液体X滴人烧瓶中,她惊奇地发现气球逐渐胀 A.请你写出液体X的化学式: (12) ,并简述理由: (13) B.该气体是灭火的常用材料,请再举一例该物质的用途: (14)
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |