
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20°C | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20°C | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20°C | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20°C | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20°C | 析出晶体b | 得溶液⑥ |
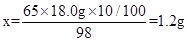 (1分)
(1分)

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:初中化学 来源:不详 题型:计算题
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
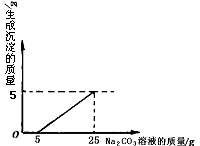
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题


查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com