
分析 根据自来水中含有的氯离子会对实验产生干扰进行分析,
(1)根据钡离子和硫酸根离子生成沉淀分析,
(2)根据银离子和氯离子会生成氯化银沉淀分析,
(3)根据汗水中也含有其他的矿物质和无机盐进行分析.
解答 解:由于自来水中是经过氯气消毒的,存在一定的氯离子,会对后面氯离子的检验产生干扰,故答案为:方法一;
(1)所有的硝酸盐都溶于水,钡离子和硫酸根离子会生成白色的硫酸钡沉淀,故答案为:不存在;
(2)所有的硝酸盐都溶于水,银离子和氯离子会生成不溶于硝酸的白色氯化银沉淀,故答案为:AgCl;
(3)汗水中除了氯化钠外也可能含有其他的无机盐,蒸发后也会出现小颗粒,故答案为:不能.
点评 本题主要考查了氯离子和硫酸根离子的检验,要加以识记.


科目:初中化学 来源: 题型:解答题
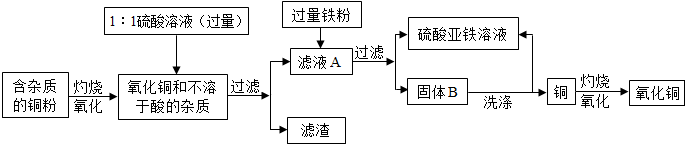
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
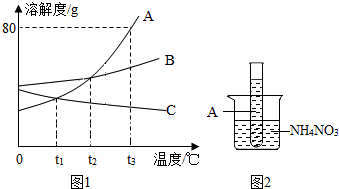
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | CaCl2 KOH Na2CO3 | B. | Na2C03、BaCl2、HCl | ||
| C. | K2CO3、CaCl2、HCl | D. | CuS04、HCl、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
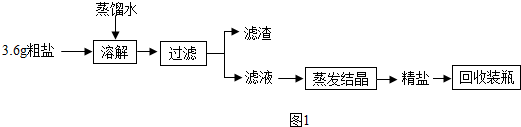
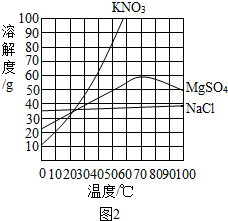
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
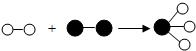 德国化学家格哈德•埃特尔,因在“固体表面的化学反应”研究张取得了开拓性成就而获得诺贝尔化学奖.他的成就之一是证实了氢气与氮气在固体催化剂表面合成氨气的反应过程.如图所示是该反应的模型图(○表示氢原子,●表示氮原子).下列说法不正确的是( )
德国化学家格哈德•埃特尔,因在“固体表面的化学反应”研究张取得了开拓性成就而获得诺贝尔化学奖.他的成就之一是证实了氢气与氮气在固体催化剂表面合成氨气的反应过程.如图所示是该反应的模型图(○表示氢原子,●表示氮原子).下列说法不正确的是( )| A. | 图示中的反应物都是单质 | |
| B. | 图示中共有3种分子 | |
| C. | 该反应属于置换反应 | |
| D. | 参加反应的氢气与氮气的分子个数比为3:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实 验 步 骤 | 解释或结论 |
| (1)将洁净的空气通过过量的NaOH溶液,再通过浓硫酸 | 通过过量的NaOH溶液的目的是为了除去空气中的二氧化碳气体. |
| (2)将处理后的气体通过能与氧气反应的物质,而除尽空气中的氧气. (雷利提醒你:反应不能生成新气体) | 除尽空气中氧气的化学方程式是2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
| (3)收集剩余气体,并测定其密度 | 密度为1.2572克/升 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 金属 | Cr | Al | Cu |
| 与盐酸反 应现象 | 气泡产生缓慢, 金属逐渐溶解 | 气泡产生激烈, 金属迅速溶解 | 无气泡产生, 金属无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com