
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加稀盐酸 | 产生无色无味气体 | 说明滤液中含有的物质是NaHCO3 |
| ②另取少量滤液于试管中,滴加足量稀HNO3后,再滴加AgNO3溶液 | 产生白色沉淀 | 证明滤液中含有NaCl |
| 第一组 | 第二组 | 第三组 | 第四组 | |
| CaCl2溶液的质量(克) | 100 | 200 | 300 | 400 |
| 产生沉淀的质量(克) | 8 | 16 | 20 | 20 |
分析 【资料回顾】
相同条件下,溶解度越小,越容易从溶液中析出;
显碱性的溶液更容易吸收二氧化碳;
碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
氯化铵和氢氧化钙在加热条件下反应生成氯化钙、水和氨气;
【定性探究】
析出碳酸氢钠固体后的溶液仍然是碳酸氢钠的饱和溶液;
【设计实验】
碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳;
【交流讨论】
银离子能和氯离子结合成白色沉淀氯化银;
【定量探究】
根据提供的数据和反应的化学方程式可以进行相关方面的计算和判断.
解答 解:【资料回顾】
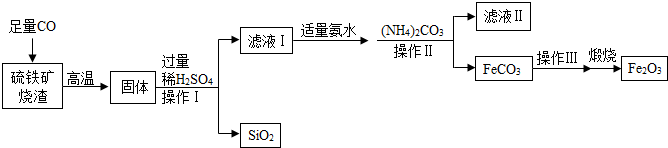
(1)第一步中析出NaHCO3固体的原因是相同条件下,碳酸氢钠的溶解度比氯化钠和碳酸钠小;
实验中先向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,其原因是使CO2更易被吸收.
故填:相同条件下,碳酸氢钠的溶解度比氯化钠和碳酸钠小;①.
(2)第二步中将滤渣加热时,碳酸氢钠分解生成碳酸钠、水和二氧化碳,发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故填:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(3)该工业同时可得副产物NH4Cl中含有氮元素,它在农业上可作氮肥;
NH4Cl与熟石灰固体加热的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
故填:氮;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
【作出猜想】
猜想Ⅰ:NH4Cl
猜想Ⅱ:NH4Cl和NaHCO3
猜想Ⅲ:NH4Cl和NaCl
猜想Ⅳ:NH4Cl、NaCl和NaHCO3.
故填:NaHCO3.
【设计实验】实验过程如下表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加稀盐酸 | 产生无色无味气体 | 证明滤液中含有的物质是NaHCO3 |
| ②另取少量滤液于试管中,滴加足量稀HNO3后,再滴加AgNO3溶液 | 产生白色沉淀 | 证明滤液中含有NaCl |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
 实验室部分装置如图所示,请回答下列问题.
实验室部分装置如图所示,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
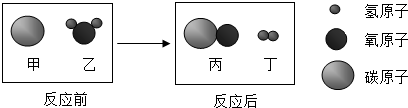
| A. | 反应前后原子的种类、数目都不变 | |
| B. | 反应前后各元素的化合价都发生了改变 | |
| C. | 乙、丙两种物质都是氧化物 | |
| D. | 该反应是置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
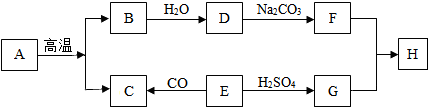
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com