
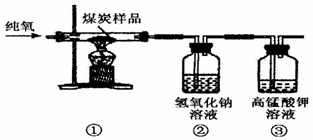
| 实验操作 | 现象 | 结论 |
| ①取少量溶液于试管中,滴加硫酸铜溶液; | 有蓝色沉淀产生 | 猜想二成立 |
| ②取少量溶液于实干中,加入氯化钡 | 有白色沉淀 | 你的猜想成立 |
分析 (1)根据稀盐酸和氢氧化钠溶液能发生反应的实质是氢离子和氢氧根离子结合生成水解答.
(2)氢氧化钠变质后生成碳酸钠也显碱性;
(3)氯气与水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,能够与氢氧化钠发生中和反应,酚酞在碱性环境下才显红色;次氯酸具有漂白性,也可能使红色的酚酞变红色,在褪色的溶液中再滴加氢氧化钠,使溶液呈碱性,若颜色变红色,说明是碱性被中和导致褪色,反之,则是被漂白了,据此解答;
(4)根据氢氧化钠和硫酸的反应进行分析解答,氢氧化钠能与硫酸反应生成硫酸钠和水;钡离子能与硫酸根离子结合产生硫酸钡白色沉淀,氢氧化钠能与硫酸铜反应生成氢氧化铜蓝色沉淀,据此解答.
(5)根据硫酸的质量和对应的化学方程式求算消耗的氢氧化钠的质量,进而求算其质量分数.
解答 解:(1)稀盐酸和氢氧化钠溶液能发生反应的实质是氢离子和氢氧根离子结合生成水(或H++OH-=H2O);
(2)氢氧化钠变质后生成碳酸钠也显碱性,都使酚酞变红,所以不能检验;
(3)盐酸和次氯酸具有酸性,能够与氢氧化钠发生中和反应,酚酞在碱性环境下才显红色;次氯酸具有漂白性,也可能使红色的酚酞变红色,故答案为:氯水中的HClO的强氧化性将酚酞氧化而褪色;
要证明红色褪去的原因可以通过以下实验:在已经褪色的溶液中继续加入NaOH溶液,直至溶液呈碱性,若溶液恢复红色,则说明是碱性被中和导致褪色,反之,则是被漂白了;
(4)【假设猜想】反应可能是恰好反应,只有硫酸钠、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钠过量,则含有氢氧化钠和硫酸钠;若硫酸过量,则含有硫酸和硫酸钠;
【实验探究】氢氧化钠能与硫酸铜反应生成氢氧化铜蓝色沉淀,所以说明溶液中含有氢氧化钠,故猜想二成立.
滴加氯化钡溶液生成白色沉淀,只能说明溶液中含有SO42-,不能判断溶液中是否含有硫酸,
(5)在红色恰好变为无色时,氢氧化钠和硫酸恰好完全反应,此时消耗硫酸的质量为:98g×20%=19.6g,
设氢氧化钠的质量为y
H2SO4+2NaOH═Na2SO4+2H2O
98 80
19.6g y
$\frac{98}{19.6g}=\frac{80}{y}$
解得:y=16g
氢氧化钠溶液中溶质的质量分数为:$\frac{16g}{100g}$×100%=16%
故答案为:(1)氢离子和氢氧根离子结合生成水(或H++OH-=H2O);
(2)不能;
(3)可能原因:氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;氯水中的HClO的强氧化性将酚酞氧化而褪色;
实验步骤、现象和结论:在已经褪色的溶液中继续加入NaOH溶液,直至溶液呈碱性,若溶液恢复红色,则说明是碱性被中和导致褪色,反之,则是被漂白了;
(4)【假设猜想】Na2SO4和H2SO4;
【实验探究】硫酸铜溶液;滴加氯化钡溶液生成白色沉淀,只能说明溶液中含有SO42-,不能判断溶液中是否含有硫酸;
(5)16%.
点评 本题考查了酸碱中和反应以及实验设计的能力,设计实验时,可以从反应后的产物和其有关的性质着手.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:选择题
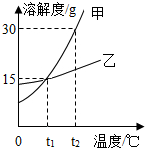 如图为甲、乙两种物质的溶解度取消,下列说法正确的是( )
如图为甲、乙两种物质的溶解度取消,下列说法正确的是( )| A. | 甲、乙两种物质的溶解度都不相等 | |
| B. | t1时,将两种饱和溶液升温至t2,溶液中溶质的质量分数都增大 | |
| C. | t1时,甲、乙两种物质的饱和溶液中,溶质质量分数均为15% | |
| D. | 将接近饱和的甲溶液变为饱和溶液,可采用蒸发或降温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
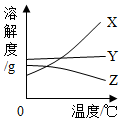 如图是X、Y、Z三种固体物质的溶解度曲线,当它们的溶液接近饱和时,分别采用增加溶质、蒸发溶剂、升高温度三种方法,均可以变成饱和溶液的是( )
如图是X、Y、Z三种固体物质的溶解度曲线,当它们的溶液接近饱和时,分别采用增加溶质、蒸发溶剂、升高温度三种方法,均可以变成饱和溶液的是( )| A. | Z溶液 | B. | Y溶液 | C. | X溶液 | D. | X、Y溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将水沿烧杯壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌 | |
| B. | 打开装有浓盐酸的试剂瓶,瓶塞应正放在桌上 | |
| C. | 用药匙去取碳酸钠粉末 | |
| D. | 测溶液pH值时,将待测液倾倒在pH试纸上,将pH试纸的颜色与标准比色卡比较即可 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
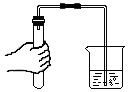 | 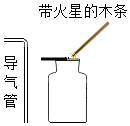 | 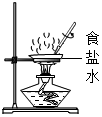 | 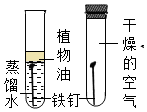 |
| A.检验装置气密性时,先用手紧握试管壁,再将导管放入水中 | B.氧气检满时先取出导管,再将带火星的木条放在集气瓶口 | C.蒸发食盐水时,铁圈上无需放置石棉网 | D.通过本图对比得出铁钉生锈的条件 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com