
【题目】根据如图所示的溶解度曲线,判断下列说法正确的是
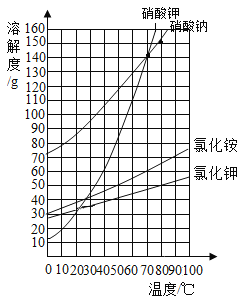
A. 50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B. 60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃ ,氯化钾析出的晶体质量多
C. 70℃时,50g硝酸钠饱和溶液中所含溶剂质量:100g硝酸钾饱和溶液中所含溶剂质量=1:2
D. 80℃时,向与100g氯化钾饱和溶液相同质量的水中加入153g硝酸钠充分搅拌后,最终硝酸钠完全溶解
【答案】C
【解析】A. 50℃时,硝酸钾的溶解度大于氯化铵的溶解度,所以50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所需水的质量是硝酸钾小于氯化铵,所得溶液的质量前者比后者小,错误;B.60℃时,硝酸钾的溶解度是110g,50g水中最多溶解55g,40g硝酸钾硝酸钾全部溶解,60℃时,氯化钾的溶解度大于40g,小于50g,所以50g水中溶解氯化钾的质量少于25g,即60℃时形成的是饱和溶液,降温到10℃,硝酸钾的溶解度小于氯化钾的溶解度,所以硝酸钾析出的晶体质量多,错误;C. 70℃时,硝酸钠的溶解度等于硝酸钾的溶解度,所以它们的饱和溶液中溶质质量分数相等,溶液具有均一性,所以70℃时,50g硝酸钠饱和溶液中所含溶剂质量:100g硝酸钾饱和溶液中所含溶剂质量=1:2,正确;D. 80℃时,氯化钾的溶解度是50g,100g氯化钾饱和溶液中所含水的质量是:100g×(1-![]() )=
)=![]() ×100g,80℃时,硝酸钠的溶解度是150g,则
×100g,80℃时,硝酸钠的溶解度是150g,则![]() ×100g水最多溶解的硝酸钠的质量为:
×100g水最多溶解的硝酸钠的质量为:![]() ×150g=100g,所以加入153g硝酸钠充分搅拌后,最终硝酸钠不能完全溶解,错误。故选C。
×150g=100g,所以加入153g硝酸钠充分搅拌后,最终硝酸钠不能完全溶解,错误。故选C。


科目:初中化学 来源: 题型:
【题目】下列化学用语书写正确的是
A. 三个二氧化硫分子:2SO3 B. 两个氮分子:2N
C. HClO中氯元素的化合价:![]() D. 一个铝离子:Al+3
D. 一个铝离子:Al+3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为研究酸的性质,某研究小组进行了如下探究。
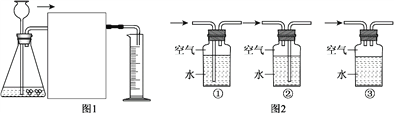
(1)小刚将颗粒大小相同的纯锌粒和粗锌粒分别加入相同浓度的稀硫酸中。写出锌与硫酸反应的化学方程式:_____________________________________________。
(2)小刚仔细观察后发现纯锌粒和硫酸的反应明显比粗锌粒慢。通过查阅资料小刚得知粗锌中含有一些不活泼金属,他猜想可能是粗锌粒中不活泼金属促进了锌和硫酸的反应。为了验证小刚的猜想,你认为应该在盛有纯锌粒和稀硫酸的试管中,加入少量的_____________(填序号)。
A.盐酸 B.氯化铜 C.氯化钠 D.氯化钙
(3)实验中小刚发现加入上述第(2)问的选项中的四种物质,纯锌粒和稀硫酸的反应都有不同程度的加快,请你分析可能的原因是___________________________________。
(4)小刚想通过用ag的粗锌粒和足量的稀硫酸反应,测量生成氢气的体积来计算粗锌粒的纯度。设计了如图1所示的实验装置,在虚线框中应接入图2中的______________(填序号),集气瓶上方残留的空气__________________(填“会”或“不会”)对氢气体积的测量造成影响。小刚实验过程中共收集到VmL的氢气(氢气的密度为![]() g/L),则该粗锌粒中锌的质量分数为_____________%(用a、
g/L),则该粗锌粒中锌的质量分数为_____________%(用a、![]() 、V表示)。
、V表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A~G为初中化学常见的物质。如图所示“→”表示转化关系,“—”表示相互能发生反应。已知A是人体胃液中含有的酸,E是最轻的气体,B和D所含元素相同。请回答:
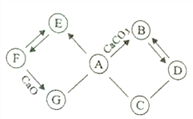
(1)写出下列物质的化学式:A__________,D____________。
(2)G物质的一种用途_________________________。
(3)写出F→E的化学反应方程式_____________________,该反应的基本类型为_______反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类生活生产离不开金属,请回答下列问题:
(1)下列现象和事实,不.可.以.用金属活动性作合理解释的是__________。
A.金属镁在空气中比铝更容易燃烧, 说明镁比铝的活动性强
B.金属铝比金属锌更耐腐蚀, 说明锌比铝活动性强
C.用硫酸铜、生石灰加水配制农药波尔多液时,不能用铁制容器
D.金属的种类很多,但在自然界中,仅有少数金属如金、银等有单质形式存在
(2)某小组用如下图所示装置对铁生锈的条件进行探究,四分钟后发现 A 中铁钉表面灰暗,B 中铁钉依然光亮,对比 A、B 现象说明:决定铁生锈快慢的一个重要因素是____。
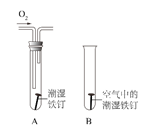
(3)多数金属以矿物形式存在于自然界,金属矿物可以用来冶炼金属。
①高炉炼铁的原料主要是铁矿石、______、石灰石、空气。工业上常用赤铁矿(主要成分是Fe2O3)在高炉中炼铁,反应的化学方程式是___________ 。
②我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到 800℃, 得到貌似金 子的铜锌合金,反应原理如下,试补充完成其中的另外两个化学方程式。
A.ZnCO3=ZnO+CO2↑
B.C+2Cu2O=_____________+CO2↑
C.____________________
(4)将mgZn和Fe的混合物中加入一定质量的CuCl2,充分反应后过滤,将滤渣洗涤, 干燥后称量质量仍为 mg,对所得滤液和滤渣的判断不正确的是_____________。
A.滤液中一定有ZnCl2和FeCl2 B.滤液为无色
C.滤渣中只有铜 D.滤渣中加稀盐酸一定有气泡产生
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋是巨大的资源宝库,全球海水中含有的盐类总质量为5亿亿吨,其中含有的各种离子占盐类总质量的百分含量如下表所示:
![]()
某工厂对海水进行综合利用的主要流程如下(本流程涉及的反应均属于复分解反应):
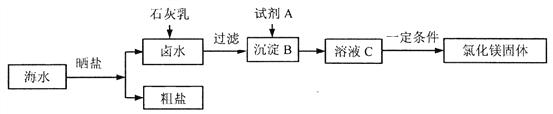
(1)蒸发时为防止液滴飞溅,除了用玻璃棒进行搅拌外,还可以采取的操作是________。
(2)卤水中加入石灰乳发生的主要反应的化学方程式为__________。
(3)己知,试剂A与沉淀B发生的是中和反应,则试剂A的名称为____________; 将卤水转化为溶液C的目的是______________。
(4)某兴趣小组设计了如下实验步骤测定氯化镁的纯度。
①称取9.5g氯化镁样品,放于烧杯中,加足量的水溶解,形成溶液;
②向上述溶液中加入90g质量分数为10%的氢氧化钠溶液;
③充分反应后,过滤;
④将沉淀用蒸馏水洗涤2~3次,洗涤得到的滤液一起并入滤液中;
⑤向最后所得的滤液中加入几滴无色酚酞试液,溶液变红,再逐滴加入10%稀硫酸(密度为1.07g·mL-1),并________,当观察到溶液恰好_______,停止加入稀硫酸;
⑥计算氯化镁样品的纯度。
则步骤④的目的是_______,为计算出氯化镁样品的纯度,除了上述数据外,还需测量的数据是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用提供的药品完成氧气、二氧化碳的制取,结合下列实验装置图回答问题。
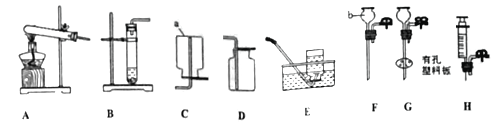
①写出仪器名称:a________、b________;
②氯酸钾制取氧气的发生装置是_____;化学方程式是_________________;有以下主要操作步骤:
a.加热 b.把药品装入试管后固定在铁架台上 c.检查装置的气密性
d.熄灭酒精灯 e.用排水集气法收集 f.从水槽中取出导管,正确的操作顺序是(写序号)_______;
③用装置B制取二氧化碳,无法对反应进行控制,请从图中选取装置______(填序号)取代B中的单孔塞,以控制该反应,使反应随时发生随时停止。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为研究金属腐蚀的条件,用细尼龙线将三根大小相同的铁钉分别固定在下图所示的三个液面高度相同的装置中,放置一星期后观察现象,下列描述不正确的是( )

A. 装置Ⅰ铁钉这一侧的液面下降
B. 装置Ⅰ、Ⅱ中的铁钉都被腐蚀
C. 比较铁钉这一侧的液面,装置Ⅰ比装置Ⅱ的高
D. 装置中Ⅲ的铁钉几乎没被腐蚀
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学利用下图所示装置探究了可燃物的燃烧条件。已知:白磷的着火点40℃,棉花的着火点150℃。

步骤①:将U型管放入冷水中,打开K1,关闭K2,向U型管中充入氧气。两端棉花都不燃烧。
步骤②:打开K2,关闭K1,向U型管中充入二氧化碳,观察到澄清石灰水变浑浊后,将U型管放入80℃热水中。两端棉花都不燃烧。
步骤③:······
步骤④:打开K2,关闭K1,向U型管中充入二氧化碳。燃烧着的棉花熄灭。
(1)步骤①的实验目的是_________________。
(2)步骤②中澄清石灰水的作用是_________________。
(3)步骤③的操作及现象是_________________。
(4)步骤④中燃着的棉花熄灭的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com