
将3.6g碳酸钙高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,求固体混合物中氧化钙的质量。
80%
解析试题分析:质量守恒定律告诉我们,化学反应前后,元素的种类、质量均不变,碳酸钙高温煅烧,发生反应:CaCO3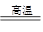 CaO+CO2↑,即CaCO3中钙元素质量等于CaO中钙元素质量,这样便可算出反应后固体剩余物的质量,再根据质量守恒定律,前后固体的质量差就是二氧化碳的质量,而在化学方程式中可以根据CaO与二氧化碳的质量关系,从而算出氧化钙的质量
CaO+CO2↑,即CaCO3中钙元素质量等于CaO中钙元素质量,这样便可算出反应后固体剩余物的质量,再根据质量守恒定律,前后固体的质量差就是二氧化碳的质量,而在化学方程式中可以根据CaO与二氧化碳的质量关系,从而算出氧化钙的质量
解解:3.6g碳酸钙中钙质量=3.6g×40/100×100%=1.44g
反应后剩余物质量=1.44÷57.6%=2.5g
生成CO2的质量=3.6g-2.5g=1.1g
设固体混合物中氧化钙的质量为x
CaCO3  CaO + CO2↑
CaO + CO2↑
56 44
x 1.1g 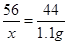
x=1.4g
考点:质量守恒定律的应用,根据化学方程式的计算


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:初中化学 来源: 题型:计算题
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合图所示的质量关系.(不计损耗)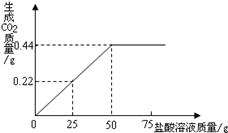
(1)样品完全反应后,共放出二氧化碳气体的物质的量为 mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室有一瓶硫酸废液,老师请小红同学设计方案测定该废液中硫酸的质量分数.小红同学先取一纯净小烧杯,称其质量为18.2g,然后往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸砂去铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9g.请回答下列问题:
(1)反应中产生的气体的质量是 。
(2)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数).
(3)如果铁钉的铁锈未除净,对(2)计算结果的影响是 (选填“偏大”、“偏小”、“无影响”),原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为检查某石灰石样品中碳酸钙的纯度,取该样品24g放入烧杯中,再向烧杯中加入70g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共85.2g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量。
(3)石灰石样品中碳酸钙的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算原过氧化氢溶液中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
取氯酸钾和二氧化锰的混合物12克制取氧气,加热一段时间后,测得50%的氯酸钾分解,将剩余的固体冷却后称量,其质量为10.08克,求原混合物中氯酸钾和二氧化锰各多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: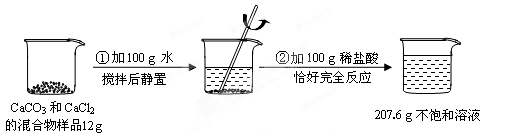
(1)实验过程中产生的CO2气体的质量为 g
(2)计算实验所用稀盐酸的溶质的质量分数(写出计算过程)。
(3)计算配制的CaCl2不饱和溶液中溶质的质量分数(写出计算过程,结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
如图1是某试剂瓶标签上的内容.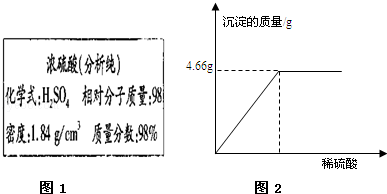
(1)要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 39 g.在用量筒量取水时若是仰视读数,将导致稀释后的硫酸溶液质量分数 (“>”、“<”或“=”)20%
(2)试计算用上述稀释用的稀硫酸测定50gBaCl2溶液的质量分数,实验数据如图2所示,写出具体的计算过程.(已知:BaCl2+H2SO4=BaSO4↓+2HCl )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com