
【题目】化学实验室常用的干燥剂“碱石灰”,碱石灰是由固体烧碱NaOH和生石灰CaO组成的混合物,极易与空气中水蒸气和CO2反应而变质。某探究小组对一瓶久置空气中的“碱石灰”作了如下探究:
(1)(假设与猜想)
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为__________。
(2)(活动与探究)如下图所示:

(3)(解释与结论)
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ_____(填“成立”或“不成立”)。
b.操作④发生化学反应的方程式为_______;由操作⑤⑥的现象判断:滤液中含有_____(写化学式);由此判断猜想Ⅰ______(填“成立”或“不成立”)。
c.综合a和b的结论,判断该样品变质情况为________。
(4)(应用与拓展)
由上述实验说明,化学实验室中干燥剂“碱石灰”应采用保存方法为_____;操作③中玻璃棒的作用是_______。
【答案】CaO+H2O=Ca(OH)2 不成立 CaCO3+2HCl=CaCl2+CO2↑+H2O Na2CO3 不成立 部分变质 密封 引流(或导流),防止溶液外溅
【解析】
(1)氧化钙与水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,故答案为:CaO+H2O=Ca(OH)2。
(3)a.因为Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,由现象②试管外壁发热可以看出,固体中一定还存在氧化钙或氢氧化钠,所以猜想Ⅱ不成立,故答案为:不成立。
b.因为滤渣加入稀盐酸产生气泡,由此可以推断滤渣就是碳酸钙,反应④就是碳酸钙和稀盐酸的反应,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,向滤液中加入稀盐酸产生气泡,加入澄清石灰水产生沉淀,因此,滤液中一定存在碳酸钠,由此可判断猜想Ⅰ不成立,故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;Na2CO3;不成立。
c.由上述a、b的分析,可知该样品变质情况为部分变质,故答案为:部分变质。
(4)因为碱石灰极易与空气中水蒸气和CO2反应而变质,因此需要密封保存,在过滤过程中玻璃棒的作用是引流,防止防止溶液外溅,故答案为:密封;引流(或导流),防止溶液外溅。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:
【题目】某化学反应的微观过程如图,则下列说法中,不合理的是( )
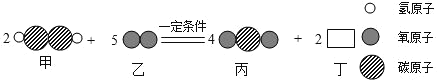
A.该反应属于置换反应B.生成物丙和丁均为氧化物
C.物质丁的化学式是H2OD.反应前后原子的种类、数目没有改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国最大钾盐产品基地出品多种含钾化合物。氯化钾可配制运动饮料,用于补充人体的电解质,最大允许使用氯化钾的质量分数为0.02%(水的密度为1g/cm3)。
(1)配制500g该种运动饮料,所需氯化钾的质量最多为__g;用托盘天平称量,氯化钾固体应放在_____(填“左盘”或“右盘”)。
(2)用量筒来量取所需的水,量筒的规格是_____(选用“50 mL”、“100 mL”或“500 mL”)。量取液体时,量筒必须放平,视线与液体的__________保持水平。
(3)若称取的氯化钾中含有水分,则所配制运动饮料的溶质质量分数会_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】多彩的“碳”,多姿的物质
(1)1-18号元素原子最外层电子数与原子序数的关系如图

①碳属于_____(填“金属”或“非金属”)元素;请画出碳原子的结构示意图_____
②图中与碳元素化学性质相似的元素是_____(填元素名称)
③从图中你发现的规律是_____(写一条)
(2)碳有几种不同的形式,如钻石石墨等,它们物理性质不同的原因是_____,它们完全燃烧的产物_____(填“相同”或“不相同”)
(3)近期化学家首次制造出纯碳环,将极大推动分子晶体管的发展科学家在高真空的室内,操作“氧碳”分子(C24O6),逐步除去其多余的含氧部分(如图),最终得到环碳分子

①制备环碳的各步骤中,每次去除的物质 X为_____(填化学式)
②一个环碳分子是由_____个碳原子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】果果在每年冬季里在她家的小药箱中会补充药物级的甘油护肤品。甘油水溶液有一定的保湿润肤作用,冬天里人们在皮肤上搽涂甘油溶液,吸湿性极强,具有较强的保水功效,使皮肤保持湿润。则回答:
(1)将甘油和水按质量比为4:1比例配制的甘油溶液护肤效果最佳,则这种甘油溶液中溶质质量分数为___。现欲配制这种甘油溶液50g,则需要纯甘油的质量为___g。
(2)若已知甘油的化学结构HOCH2CH(OH)CH2OH,则甘油的化学式为______,其相对分子质量为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】京沪高铁将于2011年7月1日正式开通运营,采用了世界最先进中国铁路Ⅱ型板式轨道系统,该轨道系统以混凝土道板、底座结构代替传统铁路道砟,可以减小高速运行下列车振动噪声小,而且轨道几何平顺性好,乘客舒适度好。则回答:
(1)在高速铁路建设中使用大量材料:①铺路基的石子;②垫在石子上的钢筋水泥柱;③钢轨等,其中水泥柱属于(_____)
A金属材料B无机非金属材料C合成材料D复合材料
(2)为适应火车提速,高速铁路的短轨已全部连接为超长轨。施工建设中,常用点燃铝和氧化铁(Fe2O3)的混合物,反应时放出大量的热进行焊接铁轨中的缝隙,并生成氧化铝和熔融状态下的铁,从而焊接钢轨间的缝隙。则有关反应的化学方程式为___________,反应类型为______________,该反应过程中______能转化为热能,并说明铝的活动性比铁____(填“强”或“弱”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列化学实验装置,回答有关问题。
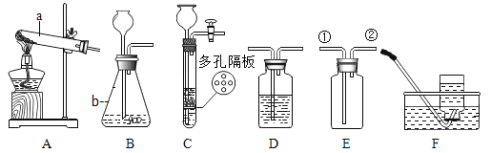
(1)写出图中标有字母的仪器的名称:a____________,b_________。
(2)实验室用A装置制取氧气反应的化学方程式为_______
(3)实验室制取二氧化碳的化学方程式是___________________________,若用装置E收集二氧化碳,则气体应从____________(填“①”或“②”)端进入;若要获得干燥的二氧化碳,可将装置B和装置D用胶皮管连接,并在装置D中盛放__________(填物质名称)试剂。
(4)实验室常用装置C代替装置B制取气体,装置C的优点是________。若用C装置制取CO2,则下列材料中可用于制作多孔隔板的是___________(填编号)。
①塑料 ②铜 ③铁
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Na2CO3和NaHCO3有相似的化学性质,都能与酸、某些碱反应。但碳酸钠稳定,而 NaHCO3受热分解:2NaHCO3![]() X+H2O+CO2↑。
X+H2O+CO2↑。
(1)生成物X的化学式为______。
(2)工业上用碳酸钠制烧碱的化学反应方程式为______。
(3)同学们在探究其化学性质实验后,将剩余固体药品集中放在烧杯中。小明为了弄清剩余固体的成份,进行了如下的探究:
(提出猜想)剩余固体是:I.Na2CO3;Ⅱ.NaHCO3;Ⅲ.______。
(进行实验)
操作 | 现象 | 结论 |
①取少量剩余固体于试管中,加入足量水,充分溶解后,滴加几滴酚酞溶液。 | 溶液由无色变红色。 | 剩余固体一定有: ______ 。 |
②取适量剩余固体于试管中,固定在铁架台上,充分加热。 | 白色固体质量减少, 试管内壁有较多水珠出现。 |
(结论分析)
①据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想______也有相同现象。
②同学们讨论后认为,如要确定剩余固体成分,小明只要做实验操作②,并补充操作______,再通过______即可得出结论。
(拓展反思)
有同学提出,碳酸钙和碳酸氢钙能不能互相转化呢?小明认为可以,因课本“资料卡片”中介绍的《石笋和钟乳石的形成》就是“CaCO3→Ca(HCO3)2→CaCO3”的过程。则“CaCO3→Ca(HCO3)2”化学反应方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com