
 钙是维持人体正常功能所必须的元素.下图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中的碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应),烧杯内物质的质量变为11.34g.请你计算:
钙是维持人体正常功能所必须的元素.下图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中的碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应),烧杯内物质的质量变为11.34g.请你计算: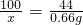
 ×100%=40%;每天摄入的钙尔奇中钙元素的质量为:1.5g×2×40%=1.2g.
×100%=40%;每天摄入的钙尔奇中钙元素的质量为:1.5g×2×40%=1.2g.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:初中化学 来源: 题型:
 钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.试计算:
钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:
 钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.试进行有关的计算:
钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.试进行有关的计算:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2009?邵阳)钙是维持人体正常功能所必需的元素.小芳服用的某种钙片的部分说明如图1,她很想知道每天服用的钙片中碳酸钙的质量.于是在家中进行了探究:取2片钙片,放人玻璃杯中,向其中加入60g 白醋,两者恰好完全反应(假设钙片中其他成分不与醋酸反应),测得玻璃杯中物质的质量(m)与反应时间(t)的关系如图2所示.反应的化学方程式:
(2009?邵阳)钙是维持人体正常功能所必需的元素.小芳服用的某种钙片的部分说明如图1,她很想知道每天服用的钙片中碳酸钙的质量.于是在家中进行了探究:取2片钙片,放人玻璃杯中,向其中加入60g 白醋,两者恰好完全反应(假设钙片中其他成分不与醋酸反应),测得玻璃杯中物质的质量(m)与反应时间(t)的关系如图2所示.反应的化学方程式:查看答案和解析>>
科目:初中化学 来源: 题型:
 钙是维持人体正常功能所必需的元素.图为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.(反应方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)
钙是维持人体正常功能所必需的元素.图为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.(反应方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com