
【题目】蛋白质是由丙氨酸(C3H7NO2) 等多种氨基酸构成。根据丙氨酸的化学式计算:
(1) C3H7NO2 的相对分子质量是_____。
(2)丙氨酸中各元素的质量比C: H: N: O=_____。
(3)丙氨酸中氮元素的质量分数为_____(计算结果保留到0.1%)。
科目:初中化学 来源: 题型:
【题目】含氮化合物是重要的化工原料。
(1)氨气是由_____(填“分子”、“原子”或“离子”)构成的。
(2)氨气溶于水显碱性,是因为氨气与水反应生成了碱,请写出这种碱的化学式_____。
(3)NH4NO3 是一种重要的氮肥,请标出 NH4NO3中氮元素的化合价_____。已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中KCl的质量分数 为_____。
(4)请完成鉴别氯化铵和硝酸铵两种溶液的实验报告。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量的盐酸和氯化钙混合溶液中逐滴滴入碳酸钠溶液,且参加反应的碳酸钠溶液的质量与生成沉淀的质量之间的关系如图所示。则下列说法正确的是 ( )
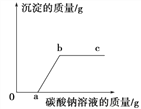
A. 反应过程中没有气泡
B. a点所处状态的溶液中溶质只有一种
C. b点比c点所处状态的溶液中氯化钠的质量分数小
D. ab线段上任意一点对应溶液的pH=7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识。请你一起研究学习,并回答有关问题。
研究问题:水溶液中复分解反应的微观实质
相关信息:
(Ⅰ)电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
(Ⅱ)相同温度下同种溶液电导率越大,离子浓度越大。
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示。
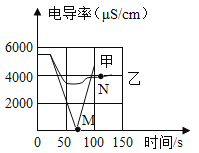
①写出Ba(OH)2与H2SO4反应的化学方程式____________。
②M点时电导率为零,离子浓度也几乎为零,此时混合液体静置后呈____________色;
③通过对甲曲线的分析,下列说法错误的是____________(填序号)。
A.M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示。
①通过对乙曲线的分析,下列说法正确的是____________(填序号)。
A.实际参加反应的是Ba2+和SO42-结合成了BaSO4,Na+和OH-还是以离子形式存在于溶液中
B.溶液红色只会变浅,但不会褪去
②N点时,溶液中大量含有的离子是___________(填离子符号)。
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度____________(填“增大”或“减小”)。
(3)拓展:
①请根据示例仿写离子方程式。
示例![]() 离子方程式:
离子方程式: ![]()
仿写: ![]() 离子方程式:____________________。
离子方程式:____________________。
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失。请推测此过程的溶液中Ca2+的浓度变化情况_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝作为金属材料在近200多年的历史中被广泛应用。根据下列资料回答:
物质的相关信息 | 铜 | 铝 |
密度(g/cm3) | 8.92 | 2.70 |
地壳中含量(质量分数/%) | 0.007 | 7.73 |
导电性(以银的导电性为100作标准) | 99 | 61 |
(1)铝的导电性比铜小,为什么高压电线常用铝制_____?
(2)用铝制高压电线时外面不需要包绝缘体,用化学方程式表示原因_____。
(3)飞机外壳用硬铝制而不用铝制的原因_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
选项 | 实验目的 | 实验过程 |
① | 证明变质 | 取少量溶液,滴加足量盐酸,将生成的气体通入澄清石灰水 |
② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
③ | 测定纯度 | 取一定量溶液,加入盐酸,用氢氧化钠固体吸收生成的气体,称量 |
④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③B.①③C.②④D.①④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料应用广“泛。
(1)地壳中含量最高的金属元素是___________,使用最广泛的金属材料是___________。
(2)铁制品锈蚀的过程实际上是铁与空气中的___________反应,防止铁钉生锈的措施之一是___________。
(3)工业上利用一氧化碳将铁从赤铁矿中冶炼出来,反应的化学方程式为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳还原氧化铜的实验如图1所示。写出该反应的化学方程式:________。
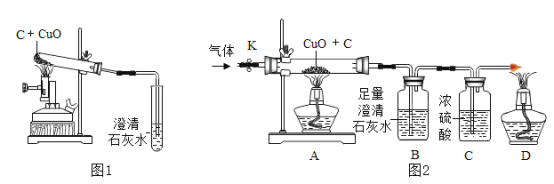
[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO。猜想②:CO2。猜想③:________。
[设计方案]实验装置如图2(浓硫酸具有吸水作用)。打开K,缓缓通人干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)实验时A处的现象是_______。
(2)若B中无明显实验现象,D处气体能被点燃,则猜想______(填序号)成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B +C(广口瓶+混合液) | m3 | m4 |
(3)若猜想②成立,则理论上(m4-m3)______(填“<”“=”或“>”)(m1-m2)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是_____。
[交流反思]实验开始前缓缓通入氮气的目的是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CH4、CO均有可燃性、还原性.按如图所示实验,反应的化学方程式为:![]()
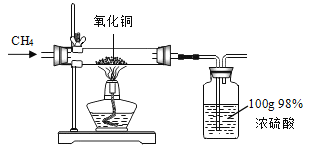
加热一段时间后测得玻璃管中剩余固体14.4g。将该固体加入盛有152g足量稀硫酸的烧杯中充分反应后过滤,得到蓝色滤液和6.4g滤渣。计算
(1)实验中通入玻璃管中CH4出的质量_____0.4g(填“>”“<”或“=”)。
(2)实验结束后,试管中浓硫酸的质量分数变为_____(计算结果精确到0.1%,不考虑损失)。
(3)计算蓝色溶液中溶质的质量分数?_____(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com