
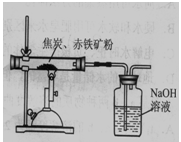
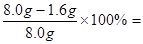 80%;方案Ⅱ 如右图所示,取8.00g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。测得氢氧化钠溶液反应前后质量增加了1.32g。如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3
80%;方案Ⅱ 如右图所示,取8.00g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。测得氢氧化钠溶液反应前后质量增加了1.32g。如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3 4Fe+3CO2↑计算,赤铁矿粉中氧化铁的质量分数,设样品中氧化铁的质量为X
4Fe+3CO2↑计算,赤铁矿粉中氧化铁的质量分数,设样品中氧化铁的质量为X 4Fe+3CO2↑
4Fe+3CO2↑

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:初中化学 来源:不详 题型:单选题
| A.运输时,要避开人口稠密区 |
| B.存放时要露天放置,紧密堆积 |
| C.取用时要轻拿轻放,不能摔、砸、碰撞 |
| D.生产厂房、仓库等建筑物之间留有足够的防火距离 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.25% | B.52% | C.50% | D.26% |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
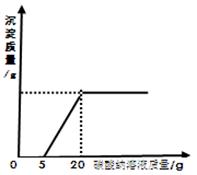
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com