
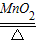 2KCl+3O2↑;
2KCl+3O2↑; 2KCl+3O2↑
2KCl+3O2↑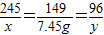
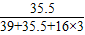 ×100%=3.55g
×100%=3.55g ×100%=22.9%;
×100%=22.9%; 2KCl+3O2↑;
2KCl+3O2↑;

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:
取若干克氯酸钾和二氧化锰的固体混合物,在试管中加热至不再有气体放出,将试管内的剩余固体冷却后溶于水,过滤、洗涤、干燥得到纯净固体3.25g,还得到
100g溶质质量分数为7.45%的滤液。(写出必要的计算过程)
(1) 写出反应的化学方程式: 。
(2) 推断试管内剩余固体中含有哪些物质?各为多少克?
(3) 计算氯酸钾的质量及反应放出气体的质量。
(4) 计算原混合物中氯元素的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com