
| A. | 过滤法 | B. | 蒸馏法 | C. | 分液法 | D. | 萃取法 |
科目:初中化学 来源: 题型:选择题
| A. | 用紫色石蕊试液鉴别CO和CO2 | B. | 用CO2鉴别烧碱溶液和澄清石灰水 | ||
| C. | 用硝酸银溶液鉴别稀盐酸和稀硫酸 | D. | 用稀盐酸鉴别纯碱和烧碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
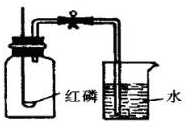 小明和小芳为了测定空气的组成,按如图进行实验:请你通过实验现象和题中信息,帮助他们完成下面的实验内容:
小明和小芳为了测定空气的组成,按如图进行实验:请你通过实验现象和题中信息,帮助他们完成下面的实验内容:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
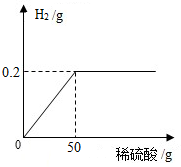 为了定量分析黄铜(铜锌合金)的组成,化学小组进行了如下实验,称取20g黄铜样品放入烧杯中,再缓慢加入适量稀硫酸并不断搅拌,测得生成的氢气与所用稀硫酸的质量关系如图所示.求:
为了定量分析黄铜(铜锌合金)的组成,化学小组进行了如下实验,称取20g黄铜样品放入烧杯中,再缓慢加入适量稀硫酸并不断搅拌,测得生成的氢气与所用稀硫酸的质量关系如图所示.求:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com