
【题目】下图为实验室中常用装置。
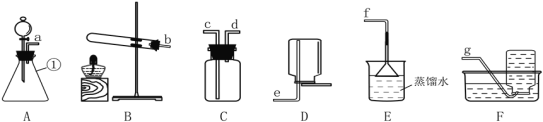
请回答下列问题:
(1)实验室用高锰酸钾制取并收集较纯净的氧气所选用的装置是_____(填装置字母),该反应的化学方程式为__。二氧化锰直接排放会造成环境污染。从充分加热后的上述剩余固体中回收二氧化锰的方法是______、过滤、洗涤和烘干(注:锰酸钾可溶于水)。
(2)夏天温度高,检查装置B的气密性,方法是:连接好仪器,把导管一端放入水中,然后___,观察到有气泡冒出,说明装置气密性良好。
(3)实验室常用锌粒和稀硫酸制取氢气,其反应的化学方程式:______。
(4)实验室制取二氧化碳的化学方程式是______,发生装置选取A的优点_____,若实验室需要制取88g的二氧化碳,则最少需要含80%CaCO3的大理石____g。
(5)通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小。常温下实验室可以用浓氨水与生石灰制取氨气。请从上图中选出合适的仪器连接成一套制备并收集氨气的装置,则装置的接口连接顺序是a→____→f,上述实验中,E装置的作用是_____。
【答案】BF 2KMnO4![]() K2MnO4+MnO2+O2↑ 溶解 用热毛巾包裹试管或用酒精灯稍加热试管 Zn+H2SO4=ZnSO4+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 随时控制反应的开始与停止 250 dc(全对才有分) 吸收氨气防止污染空气
K2MnO4+MnO2+O2↑ 溶解 用热毛巾包裹试管或用酒精灯稍加热试管 Zn+H2SO4=ZnSO4+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 随时控制反应的开始与停止 250 dc(全对才有分) 吸收氨气防止污染空气
【解析】
加热高锰酸钾属于固体加热型,生成锰酸钾和二氧化锰和氧气,收集纯净氧气用排水法,干燥氧气用向上排空气法,锰酸钾可溶于水,据此可以分离二氧化锰,锌粒和稀硫酸反应生成硫酸锌和氢气,实验室制取二氧化碳,用石灰石和盐酸反应生成氯化钙和水和二氧化碳,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小,故用向下排空气法收集氨气,常温下实验室可以用浓氨水与生石灰制取氨气,氨气污染环境,须用水吸收。
(1)加热高锰酸钾属于固体加热型,生成锰酸钾和二氧化锰和氧气,故实验室用高锰酸钾制取并收集较纯净的氧气所选用的装置是BF,化学方程式为![]() ,从充分加热后的上述剩余固体中回收二氧化锰的方法是溶解、过滤、洗涤和烘干。
,从充分加热后的上述剩余固体中回收二氧化锰的方法是溶解、过滤、洗涤和烘干。
(2)夏天温度高,检查装置B的气密性,方法是:连接好仪器,把导管一端放入水中,然后用热毛巾包裹试管或用酒精灯稍加热试管,观察到有气泡冒出,说明装置气密性良好。
(3)实验室常用锌粒和稀硫酸反应生成硫酸锌和氢气的方法来制取氢气,其反应的化学方程式:Zn+H2SO4=ZnSO4+H2↑。
(4)实验室制取二氧化碳,用石灰石和盐酸反应生成氯化钙和水和二氧化碳,化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑,发生装置选取A的优点是可以控制反应速率,还可以随时控制反应的开始与停止,设至少需要含80%CaCO3的大理石的质量为x,
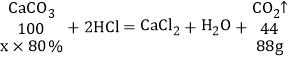
![]()
x=250g
故最少需要含80%CaCO3的大理石250g。
(5)通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小,常温下实验室可以用浓氨水与生石灰制取氨气。装置的接口连接顺序是adcf,E装置的作用是吸收氨气防止污染空气。


科目:初中化学 来源: 题型:
【题目】绿矾被广泛用于医药和工业领域。工业上利用黄铜矿粉(含杂质)主要成分为CuFeS2制取绿矾(FeSO4·7H2O)的流程图如下
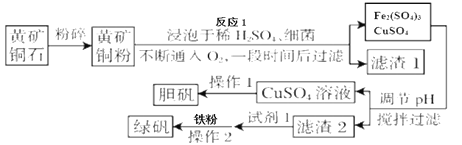
(相关资料)
①氢氧化亚铁不稳定,在空气中容易被氧气氧化成氢氧化铁。
②三价铁离子能和金属铁反应,方程式为:Fe2(SO4)3 + Fe = 3FeSO4
③FeSO4易溶于水但不溶于乙醇。
④部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表。
沉淀物 | 开始沉淀pH | 沉淀完全pH |
Cu(OH)2 | 4.2 | 6.7 |
Fe(OH)2 | 7.6 | 9.7 |
Fe(OH)3 | 1.5 | 2.8 |
(问题解答)
(1)将黄铜矿粉粹的目的是____________。
(2)在调节pH时,为了将滤渣2充分转化为沉淀而析出,需要调节溶液pH的范围为____________。在调节pH时常用铁的氧化物来调节,不选用NaOH溶液进行调节,理由是_______。
(3)最后得到的绿矾晶体用乙醇洗涤,不用水进行洗涤的目的是_______。
(4)黄铜矿粉能够在细菌作用下,与硫酸和氧气发生反应,请写出反应1的化学方程式_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁及其化合物在生产生活中应用广泛。
(一)铁的化合物制备
用废铁屑制备铁红( 主要成分为 Fe2O3)和 K2SO4 的部分流程如下图所示:
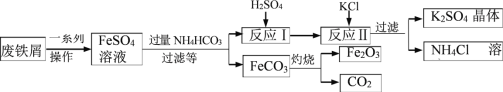
(1)加过量 NH4HCO3 反应时温度不宜过高的原因为 _____。
(2)反应Ⅰ生成的气体化学式是 _____;K2SO4 和 NH4Cl 在农业生产中都可做 _____。
(3)为检验 K2SO4 中是否混有 Cl-,要先加入足量 _____溶液,静置后再加向上层清液中滴加少量 _____溶液。
(4)在空气中灼烧 FeCO3 的化学方程式为 _____。
(二)铁的冶炼和探究
取 29.0g Fe2O3 粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
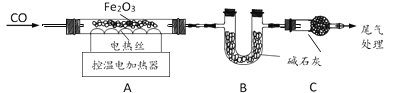
资料:碱石灰可吸收 H2O 和 CO2。
(1)连接装置,先______,再装入药品。
(2)实验时先通入 CO,目的是______。
(3)通过测定装置B 中固体质量变化情况,可求得A 中剩余固体质量,装置C 的作用是______。
(4)现直接测得装置A 中剩余固体质量为 21.0g,则装置 B 中固体应增重______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验设计不能达到其对应实验目的的是( )
选项 | 实验 | 现象 | 结论 |
A |
| 铁片表面有少量气泡,锌丝表面有较多气泡 | 说明铁与锌的活泼性 Fe<Zn |
B |
| 硫磺在空气中燃烧发出微弱的淡蓝色火焰,在氧气中发出明亮的蓝紫色火焰 | 说明硫磺在氧气中燃烧更旺盛 |
C |
| ①试管中没有明显现象 ②试管中铁钉生锈 | 说明铁生锈需要水 |
D |
| 试管中白磷燃烧,热水中白磷不燃烧 | 说明燃烧需要氧气 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】复方氢氧化镁片[有效成分Mg(OH)2]和复方碳酸镁片[有效成分MgCO3]是两种常见的抗胃酸药。从A或B中任选一个作答,若均作答,按A计分。
A | B |
(1)Mg(OH)2的相对分子质量为___________。 (2)用复方碳酸镁片治疗胃酸过多症时,反应的化学方程式为_____________。 | (1)MgCO3中氧元素质量分数的计算式为___________。 (2)用复方氢氧化镁片治疗胃酸过多症时,反应的化学方程式为__________。 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
表面地球有2/3以上都是海洋,海水为弱碱性,海洋表层水的pH约为8.2。海洋能够吸收大量空气中的二氧化碳,使地球大气层中的二氧化碳浓度降低,从而降低了地球的温室效应。
人类活动排放的二氧化碳有30%~40%会溶解于海洋等水体中。溶解的二氧化碳中的一部分会与水反应生成碳酸,导致海水的pH逐渐降低,这种现象被称为海洋酸化。
海洋酸化是对海洋生物多样性的一种威胁。在2.5亿多年前,地球经历了一次最引人注目的灭绝事件,大约90%的海洋生物和70%的陆地生物绝迹了。科学家认为,空气中二氧化碳含量的上升引起的海洋酸化,可能在古代生物灭绝事件中起到了至关重要的作用。尤其是长有坚硬外壳(主要成分是碳酸钙)的生物,如珊瑚和软体动物等,在海洋酸化的情况下,会出现外壳溶解现象而难易生存。
由于吸收了过多的二氧化碳,海洋正以前所未有的速度酸化。图中显示1990-2010年间某海域中二氧化碳浓度及海水pH的变化趋势。
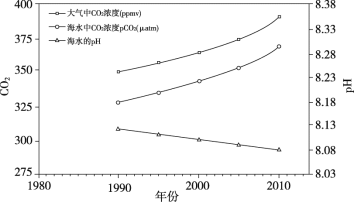
海洋酸化正在改变海洋生物赖以生存的化学环境,从而影响海洋生物的生存,导致整个海洋生物群落的发展不稳定,最终海洋将面临巨大的灾难。
依据文章内容,回答下列问题:
(1)海水中溶解的二氧化碳与水反应的化学方程式为________。
(2)珊瑚和软体动物难以在酸性条件下生存的主要原因是________。
(3)下列说法正确的是________(填字母序号)。
A 燃烧化石燃料会使空气中CO2含量上升
B 海洋吸收CO2,降低了地球的温室效应
C 海洋酸化可能在古代生物灭绝事件中起到至关重要的作用
(4)结合图中信息,解释海洋不断酸化的原因_________。
(5)写出一条解决海洋酸化问题的有效方法_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上电解海水(含氯化钠)可以得到多种化工产品,同时能处理含二氧化硫的废气,该流程如下图所示。下列说法正确的是
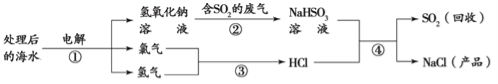
A.该流程中有两种单质
B.图中反应①属于分解反应
C.反应中硫元素的化合价发生变化
D.从海水中最终得到“NaCl(产品)”的过程是物理变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com