
 在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物,老师要求同学们探究滤液中溶质的组成.回答有关问题:
在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物,老师要求同学们探究滤液中溶质的组成.回答有关问题:分析 【提出猜想】根据碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,在反应过程中,如果二者恰好完全反应,则滤液中的溶质只有NaCl;若Na2CO3有剩余,则溶液中的溶质除了NaCl还有Na2CO3;若CaCl2有剩余,则溶液中的溶质除了NaCl还有CaCl2进行分析;
【实验探究】
(1)根据【查阅资料】可知:碳酸钠溶液显碱性,氯化钠、氯化钙溶液显中性,酚酞是一种酸碱指示剂,遇碱变红,遇酸不变色;由于“取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象”说明滤液里面没有碱性的物质进行分析;
(2)根据结论是猜想2成立,也就是证明滤液中溶质有:NaCl还有CaCl2,加入Na2CO3溶液后,碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,可观察到有白色的碳酸钙沉淀生成进行分析;
【问题讨论】(1)根据证明滤液中溶质有:NaCl还有CaCl2,加入Na2SO4溶液后,硫酸钠溶液与氯化钙溶液反应生成硫酸钙和氯化钠,可观察到有白色沉淀(CaSO4)生成进行分析;
(2)根据证明滤液中溶质有:NaCl还有CaCl2,加入AgNO3溶液后,NaCl和CaCl2都能和AgNO3反应生成沉淀进行分析.
【探索拓展】
(1)欲求该纯碱样品中碳酸钠的质量分数,须先根据化学方程式求出样品中碳酸钠的质量,再利用质量分数公式计算即可;
(2)先根据化学方程式求出生成的氯化钠的质量,用5g减去碳酸钠的质量,计算出原来的氯化钠的质量.把生成的氯化钠的质量加上原来的氯化钠的质量,就是反应后溶质的质量,再根据溶质质量分数的计算公式进行计算即可
解答 解:【提出猜想】碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,在反应过程中,如果二者恰好完全反应,则滤液中的溶质只有NaCl;若Na2CO3有剩余,则溶液中的溶质除了NaCl还有Na2CO3;若CaCl2有剩余,则溶液中的溶质除了NaCl还有CaCl2;
【实验探究】
(1)由【查阅资料】可知:碳酸钠溶液显碱性,氯化钠、氯化钙溶液显中性,酚酞是一种酸碱指示剂,遇碱变红,遇酸不变色,由于“取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象”说明滤液里面没有碱性的物质,由题意可知:溶液中没有显碱性的碳酸钠;同学们认为猜想3不成立;
(2)由于结论是猜想2成立,也就是证明滤液中溶质有:NaCl还有CaCl2,加入Na2CO3溶液后,碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;可观察到有白色沉淀生成;
【问题讨论】(1)证明滤液中溶质有:NaCl还有CaCl2,加入Na2SO4溶液后,硫酸钠溶液与氯化钙溶液反应生成硫酸钙和氯化;由于硫酸钙微溶,可观察到有白色沉淀(CaSO4)生成;所以甲同学能达到实验目的;
(2)证明滤液中溶质有:NaCl还有CaCl2,加入AgNO3溶液后,NaCl和CaCl2都能和AgNO3反应生成沉淀.NaCl和AgNO3反应生成氯化银和硝酸钠,化学方程式为:NaCl+AgNO3═AgCl↓+NaNO3;CaCl2和AgNO3反应生成氯化银和硝酸钙,化学方程式为:CaCl2+2AgNO3═2AgCl↓+Ca(NO3)2;无法证明溶液中含有CaCl2;所以乙同学不能达到实验目的,理由是:氯化钠和硝酸银反应也能够生成白色沉淀.
【探索拓展】解:设该纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为y,生成沉淀的质量为z,
参加反应的氯化钙的质量为:44.4g×10%=4.44g,则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
x 4.44g z y
$\frac{106}{x}=\frac{111}{4.44g}=\frac{100}{z}=\frac{117}{y}$
x=4.24g,z=4g,y=4.68g;
该纯碱样品中碳酸钠的质量分数为:$\frac{4.24g}{5g}$×100%=84.8%;
反应后不饱和溶液中溶质的质量为:5g-4.24g+4.68g=5.44g,反应后总溶液质量为:60g+44.4g-4g=100.4g,恰好完全反应时,
所得不饱和溶液中溶质的质量分数为:$\frac{5.44g}{100.4g}$×100%=5.4%.
故答案为:[提出猜想]CaCl2
[实验探究](1)3 (2)白色沉淀产生
[问题讨论](1)能 (2)不能 因为猜想1和猜想3都会生成白色沉淀
[探索扩展](1)84.8% (2)5.4%
点评 本题考查的重点是根据实验现象判断物质的存在情况,由此可知认真观察实验现象的重要性,要养成良好的观察习惯.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 表示氨原子,●表示氧原子,○表示氢原子).该反应的化学方程式为4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
表示氨原子,●表示氧原子,○表示氢原子).该反应的化学方程式为4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 右图中A~H是初中化学常见的物质,A俗称苏打;C可用作补钙剂;G是一种常见的氮肥,含氮量为35%;H、F物质类别相同.图中“-”两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
右图中A~H是初中化学常见的物质,A俗称苏打;C可用作补钙剂;G是一种常见的氮肥,含氮量为35%;H、F物质类别相同.图中“-”两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.查看答案和解析>>
科目:初中化学 来源:2017届江苏省高邮市九年级下学期第一次网上阅卷适应性训练(一模)化学试卷(解析版) 题型:简答题
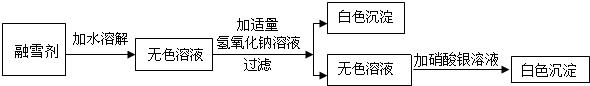
碱式碳酸铜可用于生产木材防腐剂等。工业上常在含有硫酸铜的废水中加入碳酸钠溶液,得到碱式碳酸铜沉淀。
(1)产品生产中加入Na2CO3溶液时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如图所示,沉淀时溶液pH最好控制在_________左右。
(2)实验探究
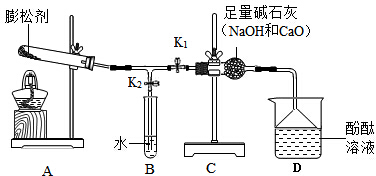
Ⅰ.验证碱式碳酸铜的分解产物,可选装置如图所示。

甲同学将装置按BCA的顺序组合进行实验,装置A中盛放的试剂的作用是___________,装置C中的现象为___________。装置C、A顺序不能颠倒的原因是___________。
实验结束,B装置中粉末完全变黑。关于黑色物质的成分,有人认为可能有碳,请从物质的物理性质和元素守恒角度说明此猜想的依据是_____________。
乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 | 观察到的现象 | 获得结论 | 反应的化学方程式 |
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | _______ | 黑色粉末均为氧化铜 | _______ |
Ⅱ.丙同学探究CO还原CuO所得固体产物的成分,实验装置如下图:

资料:CO还原CuO的实验过程中,固体产物可能有Cu2O(红色固体)、Cu。
反应前 | 反应后 |
玻璃管和内盛氧化铜 粉末的总质量为62.0 g | 玻璃管和内盛红色 粉末的总质量为61.7 g |
玻璃管的质量为60.0 g | |
(1)打开K,缓缓通入CO气体,一段时间后加热。当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却。
①由实验数据计算可知,CuO中铜元素的质量为_________g,红色固体粉末成分为_________。
②下列有关该实验的说法正确的是_____________。
A.先通入一会CO再加热是为了排净装置中的空气
B.实验结束必须先将玻璃管与虚线框内的装置分开,防止溶液倒吸
C.装置图中虚线框内的装置既能吸收二氧化碳,又能收集一氧化碳
D.排入到烧杯中的溶液可能显碱性,也可能显中性
Ⅲ.工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。为测定某种产品的组成,丁同学设计的实验方案中有如下步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g。请根据实验数据,计算确定该碱式碳酸铜的化学式。写出计算过程。_______
查看答案和解析>>
科目:初中化学 来源:2017届江苏省高邮市九年级下学期第一次网上阅卷适应性训练(一模)化学试卷(解析版) 题型:选择题
红枣醋饮中含有一种酸(C4H6O5),具有美容养颜,解酒护肝健胃的重要用途。下列关于红枣醋饮说法中正确的是
A.该酸由15个原子构成 B.该酸的相对分子质量为134
C.该酸中氢元素的质量分数最大 D.胃酸过多病人养胃首选饮料
查看答案和解析>>
科目:初中化学 来源:2016-2017学年黑龙江省大庆市杜尔伯特蒙古族自治县八年级(五四制)下学期期中考试化学试卷(解析版) 题型:选择填充题
元素R在化合物中的化合价只有一种,已知其氧化物的式量为m,其氯化物的式量为n,则R的化合价数值为 ( )
A. 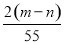 B.
B.  C.
C.  D.
D. 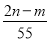
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com