
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
| 加热前质量(g) | 加热后质量(g) | |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
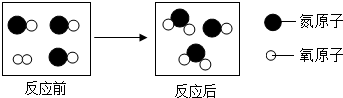
| A. | 反应前后分子数目改变 | B. | 反应前后元素种类不变 | ||
| C. | 反应前后的质量比为45:16 | D. | 反应前后氮元素化合价发生改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
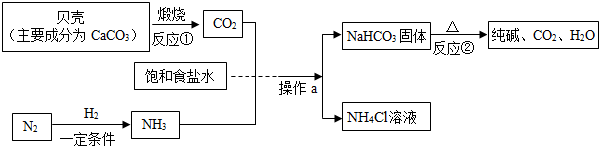
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 操作方法 |
| A | Fe (Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
| B | CaO粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| C | CuSO4 (H2SO4) | 加入足量的NaOH溶液,充分反应后过滤 |
| D | NaOH溶液(Na2CO3) | 加入适量Ca(OH)2溶液,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
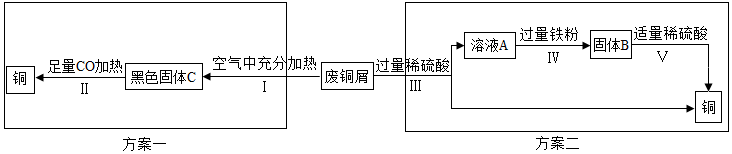
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
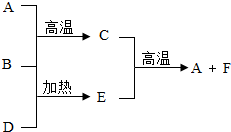 A是最常见的金属单质,B、D是常见的非金属单质,并且B和D反应,因B和D参于反应的相对量不同,可生成E或F.它们之间有RU 图所示的转化关系.
A是最常见的金属单质,B、D是常见的非金属单质,并且B和D反应,因B和D参于反应的相对量不同,可生成E或F.它们之间有RU 图所示的转化关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com