
| 实验方法 | 可能观察到的现象 | 结论 |
| |


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:
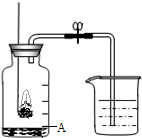 空气是一种宝贵的自然资源.空气中主要含有氮气和氧气.如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水.做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸人瓶中并把塞子塞紧.待红磷熄灭后.发现红磷还有剩余,冷却,打开弹簧夹.烧杯中的水倒流进集气瓶中.液面上升到图中A的位置.
空气是一种宝贵的自然资源.空气中主要含有氮气和氧气.如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水.做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸人瓶中并把塞子塞紧.待红磷熄灭后.发现红磷还有剩余,冷却,打开弹簧夹.烧杯中的水倒流进集气瓶中.液面上升到图中A的位置.查看答案和解析>>
科目:初中化学 来源: 题型:
 32、化学兴趣小组同学们在课外活动中设计了如图装置来验证某气体的化学性质.
32、化学兴趣小组同学们在课外活动中设计了如图装置来验证某气体的化学性质.| 仪器名称 | 分液漏斗 | 广口瓶中 |
| 装置内的药品 | H2O |
CO2 |
| 可观察到的现象 | 气球变大 | |
| 用化学方程式表示相关性质 | CO2+H2O=H2CO3 | |
 (2)同学们又设计以下实验(如图)研究某混合气体的组成.
(2)同学们又设计以下实验(如图)研究某混合气体的组成.
查看答案和解析>>
科目:初中化学 来源: 题型:
 29、空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
29、空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2007?茂名)某同学设计和进行了如下实验:
(2007?茂名)某同学设计和进行了如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com