
【题目】将CO2通入滴有酚酞的BaCl2、NaOH混合溶液中,出现白色沉淀。下列说法错误的是( )
A. 溶液的红色逐渐变浅或变为无色
B. 产生白色沉淀的化学方程式为:![]()
C. 反应后的溶液中一定有NaCl
D. 反应过程中,溶液里的![]() 、NaOH的质量分数均减小
、NaOH的质量分数均减小
【答案】B
【解析】
A、因为氢氧化钠属于碱,能使酚酞变红,通入二氧化碳后,二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡反应生成碳酸钡沉淀和氯化钠,所以碱性会减弱或消失,所以溶液的红色逐渐变浅或变为无色,故A说法正确;
B、产生白色沉淀的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,故B错;
C、二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡反应生成碳酸钡沉淀和氯化钠,所以最后溶液中一定含有氯化钠,故C说法正确;
D、根据二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡反应生成碳酸钡沉淀和氯化钠,可知BaCl2、NaOH都是反应物,在不断减少,所以质量分数在不断减小。故D说法正确。
故选:B。


科目:初中化学 来源: 题型:
【题目】下图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:
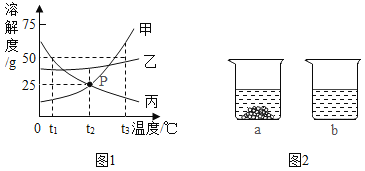
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是_________。
(2)P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为_____。
(3)t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,
则烧杯a中溶解的物质是________(填“甲”或‘‘乙”),所得溶液的质量为______g。
(4)当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用______(填(“降温”或“蒸发”)结晶的方法提纯甲物质。
(5)下列说法正确的是____(填字母序号)。
A 将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B 将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质最分数增大
C 将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D 将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】判断化学反应发生的根本依据应该是有新物质生成.
(1)两种物质的溶液混合后,若有沉淀、气体产生,可以帮助我们判断化学反应是否发生.请写出一有沉淀产生,且属于复分解反应类型的化学方程式_______________.
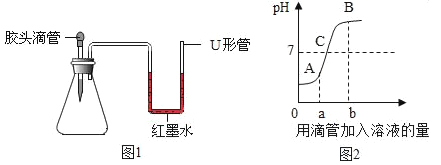
(2)氢氧化钠与CO2反应时无明显现象.如图1是某同学设计的实验装置,其气密良好.
①若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后观察到什么现象______________并写出发生反应的化学方程式______.
②小明同学认为原因是二氧化碳溶于了水中所造成的.请你在上述实验的基础,进一步做补充实验,证明氢氧化钠和二氧化碳确实发生了化学反应(要求写出实验操作及判断依据)_______
(3)氢氧化钠溶液与稀盐酸发生反应过程中溶液pH变化如图2所示.
①B点表示的溶液中溶质为:_____
②该实验过程中,后用滴管加入的溶液为_____;
③为探究盐酸与氢氧化钠溶液是否发生反应,某同学在两者混合后溶液样品中加硝酸银溶液,看是否产生白色沉淀.同学们认为此方案不正确,请简述其中的理由__________
(4)称取12.5g石灰石(杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.应结束后称量烧杯中剩余物质的总质量为58.lg(不包括烧杯的质量,且气体的溶解忽略不计).请算:石灰石中杂质的质量分数是多少?_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
(查阅资料)
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液没有气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和NH3.
(问题探究)
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式_____.
(2)工业级NaN3中常含有少量的Na2CO3,其原因是_____(用化学方程式表示).
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,小组同学设计了如图实验装置.
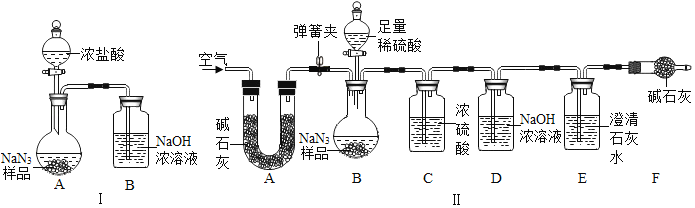
①小明同学认为通过测定装置Ⅰ中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组同学通过讨论装置Ⅰ认为很多因素会导致测定数据不准确,误差太大.小明同学在大家讨论的基础上,又设计了装置Ⅱ.请装置Ⅱ中A的作用是_____;若无装置C,对测定结果造成的影响是_____(填“偏大”、“偏小”或“无影响”);装置E的作用是_____.
②根据装置Ⅱ,小组同学设计的实验步骤有:
a.称量装置
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
为保证测定结果精确,正确的操作顺序为_____(填字母序号,可重复).
③计算碳酸钠的质量分数时,至少需要测定_____个数据.(填数字)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如下图所示.
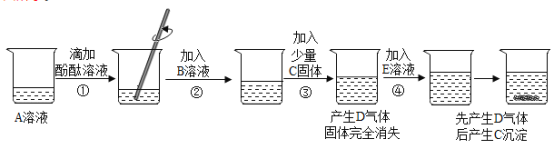
回答下列问题:
(1)A溶液一定呈_____性(填“酸”或“中”或“碱”).
(2)气体D的化学式为___________________.
(3)步骤②的实验现象为__________________________.
(4)E溶液中的溶质可能是_______________.
(5)B溶液的溶质由两种元素组成,④中产生气体的反应的化学方程式为______________________.
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,已知A与E中的阳离子相同,则实验后所得溶液含有的溶质为______________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有NaCl、AgCl、![]() 三种物质的固体混合物,要将它们逐一分离出来,现进行下列实验:
三种物质的固体混合物,要将它们逐一分离出来,现进行下列实验:

(1)根据实验判断X、Y、Z依次为______![]() 填写化学式
填写化学式![]() 。
。
(2)实验中操作![]() 的名称是______,操作
的名称是______,操作![]() 的名称是______。
的名称是______。
(3)该物质分离过程中至少需要______、______、______、铁架台、酒精灯、药匙等仪器。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取一定量氧化铁与氧化铜的混合物,向其中加入100克、7.3%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是 ( )
A.6.4克B.3.2克C.1.6克D.0.8克
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~F是初中化学常见的物质。已知B是常用的建筑材料,C、D常温为气体,F属于碱类物质。
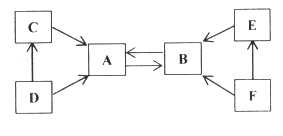
(1)写出A、F的化学式
A._____ F._____
(2)写出C→A的化学方程式_____
(3)D的用途为_____。
(4)写出E→B的化学方程式_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式符合题意且书写和基本反应类型都正确的是( )
A.金属铁与稀盐酸反应: 2Fe+6HCl==2FeCl3+3H2↑ 置换反应
B.验证Fe和Zn的金属活动性: Zn+FeCl2==ZnCl2+Fe 置换反应
C.铝在空气中形成氧化膜: 2Al+3O2== 2Al2O3 化合反应
D.打开汽水瓶时碳酸分解: H2CO3==H2O+CO2 分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com