


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
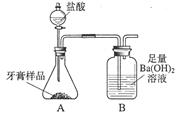
小学能力测试卷系列答案科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
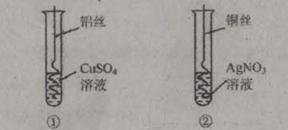
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
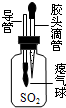
科目:初中化学 来源:不详 题型:实验题

| | NaCl溶液 | Na2SO4溶液 | Na2CO3溶液 |
| 加入稀盐酸 | 无明显变化 | 无明显变化 | 现象Ⅰ |
| 加入BaCl2溶液 | 无明显变化 | 产生白色沉淀 | 产生白色沉淀 |
| 加入AgNO3溶液 | 产生白色沉淀 | 溶液略呈浑浊 | 产生淡黄色沉淀 |
| 序号 | 加入试剂及操作 | 没有使用的暖袋 | 失效后的暖袋 |
| I | 加入足量水观察 | 无色溶液,大量固体在烧杯底部 | 无色溶液,大量固体在烧杯底部 |
| Ⅱ | 取I中上层清液,向其中滴加盐酸 | 无变化 | 无变化 |
| Ⅲ | 取I中上层清液,向其中滴加BaCl2溶液 | 无变化 | 无变化 |
| Ⅳ | 取I中上层清液,向其中滴加AgNO3溶液 | 白色沉淀 | 白色沉淀 |
| Ⅴ | 另取黑色粉末加入足量盐酸 | 大量气泡,溶液呈浅绿色 | 无气泡,溶液呈黄色溶液 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验方法和步骤 | 实验现象(预期) | 分析 |
| | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
| 取小烧杯中的物质进行 (填操作名称),得到固体和液体。 |  | 猜想三正确 |
| 向滤液中加入适量 溶液; | 溶液变蓝 | |
| 向固体中加入适量稀盐酸。 | |
| 加入盐酸溶液的质量/g | 0 | 2 | 3.65 | 6 |
| 样品的pH | 12 | 9 | 7 | 4 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
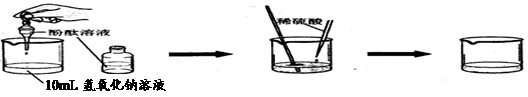
| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 | ①溶液颜色 ; ②不断搅拌溶液至溶液颜色变成 色。 | 酸和碱发生了中和反应 |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 甲同学的方案 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 乙同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
| 丙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
查看答案和解析>>
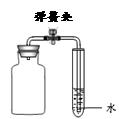
科目:初中化学 来源:不详 题型:实验题

 ;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下:
;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下: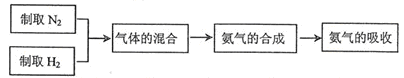
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
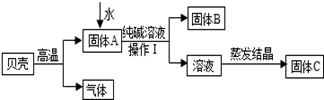

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com