
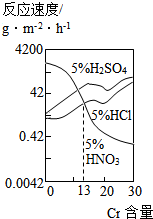
 如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列说法正确的是( )
如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列说法正确的是( )| A. | 稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强 | |
| B. | 随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱 | |
| C. | Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl>HNO3 | |
| D. | Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
分析 A.由图中的曲线变化可知,硫酸对金属的腐蚀速率随Cr含量增加而变大;
B.由图中的曲线变化可知,随着Fe含量增加,酸腐蚀性增强;
C.由图中的曲线变化可知,Cr含量等于13%时,盐酸、硝酸氢离子浓度相等,腐蚀速率与氢离子浓度大小成正比;
D.Cr含量小于13%时,三种酸中,有一段硝酸的氢离子浓度最大.
解答 解:根据图中的纵横坐标可知,横坐标为Cr含量,纵坐标为金属被腐蚀的反应速率.
A.由图可知,硫酸对金属的腐蚀速率随随Cr含量增加而变大,当铬的含量远低于于13%时,稀硫酸对合金的腐蚀速率比盐酸、硝酸弱,故A错误;
B.Fe-Cr合金中铁的含量与铬的含量呈反比,由图可知,随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱,故B正确;
C.Cr含量等于13%时,盐酸、硝酸氢离子浓度相等,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl=HNO3,故C错误;
D.Cr含量小于13%时,三种酸中,有一段曲线表明硝酸的氢离子浓度最大,对Fe-Cr合金的腐蚀性最强,故D错误.
故选:B.
点评 本题以图形来考查学生对金属腐蚀的认识,明确图形中的曲线变化趋势及曲线的交点的含有是解答的关键,并能利用金属与酸的反应来分析解答金属的腐蚀,题目难度中等.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 向下表的甲物质逐滴加入相应的乙溶液至过量,反应过程中生成的气体或沉淀的质量与加入乙的质量关系,能用如图所示的曲线表示的是( )
向下表的甲物质逐滴加入相应的乙溶液至过量,反应过程中生成的气体或沉淀的质量与加入乙的质量关系,能用如图所示的曲线表示的是( )| 序号 | 甲 | 乙 |
| A | 硫酸和硫酸铜的混合溶液 | 氢氧化钠溶液 |
| B | 盐酸和稀硫酸的混合溶液 | 氯化钡溶液 |
| C | 氢氧化钠和硫酸钠的混合溶液 | 稀盐酸 |
| D | 铁钉 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | m(KClO3)/g | m(MnO2)/g | m(CuO)/g | 回收催化剂质量/g |
| ① | 0.6000 | -- | -- | -- |
| ② | a | 0.2000 | -- | 0.1950 |
| ③ | b | -- | c | 0.1900 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质 | 田 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | m | 8 | 6 |
| 反应后质量/g | 4 | 待测 | 28 | 2 |
| A. | “待测”数据为m | B. | 乙一定是该反应的催化剂 | ||
| C. | 该反应属于化合反应 | D. | 反应中甲和丙的质量比为4:5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该物质不可以燃烧 | B. | 该物质化学性质比较稳定 | ||
| C. | 可重复使用 | D. | 可处理海上石油泄漏 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com