
”¾ĢāÄæ”æŹµŃéŹŅŅŌÖÖ¹¤Ņµ·ĻŌü(Ö÷ŅŖ³É·ÖĪŖMgCO3”¢MgOŗĶSiO2)ĪŖŌĮĻÖʱø:MgCO3”¤3H2O.ĘäÖ÷ŅŖŹµŃéĮ÷³ĢČēĶ¼, ŅŃÖŖ: SiO2²»ČÜÓŚĖ®£¬³£ĪĀĻĀ²»ÓėĮņĖį”¢Ģ¼ĖįÄĘ·“Ó¦”£MgCO3²»ČÜÓŚĖ®£¬µ«æÉÓėĖį·“Ó¦”£
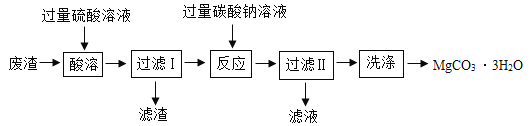
£Ø1£©ĪŖĮĖ¼Óæģ·ĻŌüµÄ”°ĖįČÜ”±ĖŁĀŹ£¬æɲÉÓƵİģ·ØÓŠ____ (ČĪŠ“Ņ»µć)£¬¹żĀĖŹ±ÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ:ÉÕ±”¢Ā©¶·”¢_____”£
£Ø2£©¼ÓČė¹żĮæĢ¼ĖįÄĘČÜŅŗŗó·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____£»_____”£
£Ø3£©”°¹żĀĖII”±ĖłµĆĀĖŅŗÖŠŗ¬ÓŠµÄÖ÷ŅŖĄė×ÓÓŠ_____(ĢīĄė×Ó·ūŗÅ)”£
£Ø4£©”°·“Ó¦”±²½ÖčĒ°ŗó¾łÓŠ¹żĀĖ£¬ÄÜ·ńŹ”Č„”°¹żĀĖI”±Ö»½ųŠŠ”°¹żĀĖII”±”£___ ( Ģī”°ÄÜ”±»ņ”°·ń”±)£¬ĄķÓÉŹĒ_____”£
£Ø5£©”°ĖįČÜ”±Ź±Ėł¼ÓĮņĖįČÜŅŗ²»ŅĖ¹żĮæĢ«¶ąµÄŌŅņŹĒ_____”£
”¾“š°ø”æ¼ÓČČÉżĪĀ£»½Į°č£» ĢįøßĮņĖįµÄÅØ¶Č ²£Į§°ō Na2CO3+H2SO4=Na2SO4+H2O+CO2”ü Na2CO3 +MgSO4 =Na2SO4+MgCO3”ż Na+”¢![]() ”¢
”¢![]() ·ń µ¼ÖĀ²śĘ·²»“æ(»ņŹ¹ŃłĘ·ÖŠŗ¬ÓŠŌÓÖŹSiO2(ŗĻĄķŅ²æÉ) ±ÜĆāÖʱø²śĘ·Ź±ĻūŗÄøü¶ąµÄĢ¼ĖįÄĘ(»ņĻūŗÄ“óĮæµÄĢ¼ĖįÄĘ) (ŗĻĄķŅ²æÉ)
·ń µ¼ÖĀ²śĘ·²»“æ(»ņŹ¹ŃłĘ·ÖŠŗ¬ÓŠŌÓÖŹSiO2(ŗĻĄķŅ²æÉ) ±ÜĆāÖʱø²śĘ·Ź±ĻūŗÄøü¶ąµÄĢ¼ĖįÄĘ(»ņĻūŗÄ“óĮæµÄĢ¼ĖįÄĘ) (ŗĻĄķŅ²æÉ)
”¾½āĪö”æ
£Ø1£©¼ÓČČÉżĪĀ”¢½Į°č”¢ĢįøßĮņĖįµÄÅØ¶Č£¬æÉŅŌ¼Óæģ·ĻŌüµÄ”°ĖįČÜ”±ĖŁĀŹ£¬¹żĀĖŹ±ÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ£ŗÉÕ±”¢Ā©¶·”¢²£Į§°ō£¬¹ŹĢī£ŗ¼ÓČČÉżĪĀ”¢½Į°č”¢ĢįøßĮņĖįµÄÅØ¶Č£»²£Į§°ō”£
£Ø2£©”°ĖįČÜ”±Ź±Ńõ»ÆĆ¾ŅŌ¼°Ģ¼ĖįĆ¾ÓėĮņĖį·“Ó¦£¬¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖMgO+H2SO4= MgSO4+H2OŗĶMgCO3+H2SO4=MgSO4+H2O+CO2”ü¼ÓČė¹żĮæĢ¼ĖįÄĘŗó£¬Ģ¼ĖįÄĘŗĶĮņĖįĆ¾·“Ӧɜ³ÉĢ¼ĖįĆ¾³ĮµķŗĶĮņĖįÄĘ£¬ŗĶĮņĖį·“Ӧɜ³ÉĮņĖįÄʶžŃõ»ÆĢ¼ŗĶĖ®£¬»Æѧ·½³ĢŹ½ĪŖNa2CO3+H2SO4=Na2SO4+H2O+CO2”ü£¬Na2CO3 +MgSO4 =Na2SO4+MgCO3”ż£¬¹ŹĢī£ŗNa2CO3+H2SO4=Na2SO4+H2O+CO2”ü£»Na2CO3 +MgSO4 =Na2SO4+MgCO3”ż”£
£Ø3£©¹żĀĖIIĖłµĆĀĖŅŗÖŠŗ¬ÓŠ¹żĮæĢ¼ĖįÄĘŗĶĮņĖįÄĘ£¬Ö÷ŅŖĄė×ÓÓŠNa+”¢![]() ”¢
”¢![]() £¬¹ŹĢī£ŗNa+”¢
£¬¹ŹĢī£ŗNa+”¢![]() ”¢
Ӣ![]() ӣ
ӣ
£Ø4£©²»ÄÜŹ”Č„”°¹żĀĖI”±Ö»½ųŠŠ”°ĀĖŅŗII”±£¬ŅņĪŖ¶žŃõ»Æ¹č²»ČÜÓŚĖ®£¬³£ĪĀĻĀ²»ÓėĮņĖį”¢Ģ¼ĖįÄĘ·“Ó¦£¬Čē¹ūŹ”ĀŌ”°¹żĀĖI”±£¬»įµ¼ÖĀµĆµ½µÄ²śĘ·ŅņĪŖ»ģÓŠ¶žŃõ»Æ¹č¶ų²»“棬¹ŹĢī£ŗ·ń”£
£Ø5£©¹żĮæµÄĮņĖįŠčŅŖ¼ÓČėĢ¼ĖįÄĘ½ųŠŠ³żŌÓ,ĖłŅŌ”°ĖįČÜ”±Ź±Ėł¼ÓĮņĖįČÜŅŗ²»ŅĖ¹żĮæĢ«¶ąµÄŌŅņŹĒ±ÜĆāÖʱø²śĘ·Ź±ĻūŗÄøü¶ąµÄĢ¼ĖįÄĘ£¬¹ŹĢī£ŗ±ÜĆāÖʱø²śĘ·Ź±ĻūŗÄøü¶ąµÄĢ¼ĖįÄĘ”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøÖĢś¹¤ŅµŹĒŅ»øö¹ś¼Ņ¹¤Ņµ»Æ·¢Õ¹µÄÖ§Öł²śŅµ£¬ĻĀĶ¼ŹĒŹµŃéŹŅŗĶ¹¤ŅµĮ¶ĢśµÄŹ¾ŅāĶ¼£¬Ä³Ń§Š£²ÉÓĆ”°ĪŹĢāĢ½¾æŹ½"æĪĢĆ½Ģѧ£¬“Ó¶ų½ā¾öĪŹĢā”£ĒėÄć²ĪÓėĶź³ÉĻĀĮŠĪŹĢā”£
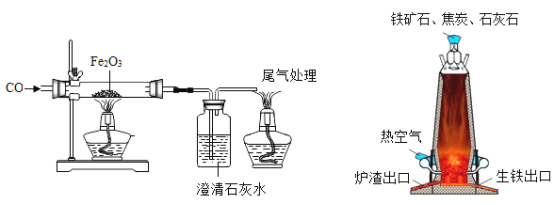
£Ø1£©ŹµŃ鏱ČōĻČøųѳʷ¼ÓČČ£¬ŌŁĶØŅ»Ńõ»ÆĢ¼æÉÄܲśÉśµÄŗó¹ūŹĒ_______”£
£Ø2£©±ŲŠė½ųŠŠĪ²Ęų“¦ĄķµÄŌŅņŹĒ___”£Š”Ć÷Ķ¬Ń§ČĻĪŖĪ²ĘųæÉĻČ“¢“ęŌŚĘæÄŚ£¬Č»ŗóŌŁ“¦Ąķ£¬ČēĶ¼ŹĒĖūÉč¼ĘµÄÖüĘųĘæ,a£¬bĮ½¹ÜÓ¦ČēŗĪÉģČė£¬Ēė½«Ķ¼²¹³äĶźÕū(Ī²Ęų“Óa¹ÜĶØČė) __”£
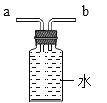
£Ø3£©Š”øÕĶ¬Ń§Ģį³öÖŹŅÉ:COÄÜ·ńŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē?Ņņ“Ė£¬ĖūÉč¼ĘŌŚCOĶØČė²£Į§¹ÜÖ®Ē°£¬Ó¦ĻČĶØČė³ĪĒåŹÆ»ŅĖ®£¬ŅŌÅųżCOÓė³ĪĒåŹÆ»ŅĖ®µÄ·“Ó¦£¬ŹŌ¶Ō“Ė×÷³öĘĄ¼Ū”£ÄćČĻĪŖŠ”øÕĶ¬Ń§µÄÉč¼Ę___________(Ģī"ÓŠ"»ņ”°Ć»ÓŠ")±ŲŅŖ£¬ĄķÓÉŹĒ___;Ī²ĘųÄܹ»Ź¹³ĪĒåŹÆ»ŅĖ®±ä»ė×ĒµÄ·“Ó¦ŌĄķŹĒ__”£
£Ø4£©¹¤ŅµĮ¶ĢśÖŠ½¹ĢæµÄ×÷ÓĆŹĒ__
£Ø5£©ĻÖ½«40 tŗ¬Ńõ»ÆĢś80%µÄĢśæóŹÆÓė×ćĮæŅ»Ńõ»ÆĢ¼³ä·Ö·“Ó¦ £¬ĄķĀŪÉĻæɵƵ½ĢśµÄÖŹĮæŹĒ¶ąÉŁ__?
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ĖłŹ¾ĪŖŹµŃéŹŅÖŠ³£¼ūµÄĘųĢåÖʱøŗĶŹÕ¼Æ×°ÖĆ”£
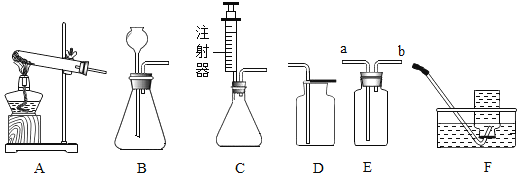
£Ø1£©ŹµŃéŹŅÓĆ¼ÓČČĀČĖį¼ŲŗĶ¶žŃõ»ÆĆĢµÄ»ģŗĻĪļÖĘČ”ŃõĘų£¬Ó¦Ń”ÓĆ·¢Éś×°ÖĆ________(Ģī×ÖÄøŠņŗÅ)£¬·“Ó¦µÄĪÄ×Ö±ķ“ļŹ½ĪŖ_______”£ŹŌ¹ÜæŚĀŌĻņĻĀĒ抱µÄŌŅņŹĒ____ŹµŃé½įŹųŗó£¬Ó¦ĻČ________£¬ŌŁ _______£¬·ĄÖ¹_____”£
£Ø2£©ČōÓĆF×°ÖĆŹÕ¼ÆŃõĘų£¬____________ æŖŹ¼ŹÕ¼Æ£¬_______Ö¤Ć÷ŹÕ¼ÆĀśĮĖ”£ČōÓĆ×°ÖĆDŹÕ¼ÆŃõĘų£¬ŃéĀśµÄ·½·ØŹĒ_________________”£
£Ø3£©ŹµŃéŹŅÓĆ¹żŃõ»ÆĒāČÜŅŗŗĶ¶žŃõ»ÆĆĢÖĘČ”ŃõĘų£¬ČōŃ”ÓĆB×ö·¢Éś×°ÖĆ£¬¼ÓČėŅ©Ę·Ē°Ó¦ĻČ________¾ßĢå×ö·ØŹĒ_________ČōŃ”ÓĆC×ö·¢Éś×°ÖĆ£¬ÄćČĻĪŖŃ”ÓĆCµÄÓŵćŹĒ________”£
£Ø4£©ÓūŹ¹ÓĆ×°ÖĆEÓĆÅÅæÕĘų·ØŹÕ¼ÆŃõĘų£¬ŌņĘųĢåÓ¦“Ó______£ØĢī”°a”±»ņ”°b”±£©¶ĖĶØČė£»ÓūŹ¹ÓĆ×°ÖĆEÓĆÅÅĖ®·ØŹÕ¼ÆŃõĘų£¬ĻČ½«Ęæ֊װĀśĖ®£¬ŌŁ½«ĘųĢå“Ó______£ØĢī”°a”±»ņ”°b”±£©¶ĖĶØČė”£
£Ø5£©ŅŃÖŖŅ»Ńõ»ÆµŖĘųĢåÄŃČÜÓŚĖ®£¬ŌŚæÕĘųÖŠČŻŅ×ÓėŃõĘų·¢Éś·“Ó¦£¬ŌņŹÕ¼ÆŅ»Ńõ»ÆµŖĘųĢåŹ±Ó¦Ń”ÓĆĶ¼ÖŠ×°ÖĆ________(Ģī×ÖÄøŠņŗÅ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮĖ½āĪļÖŹµÄ×é³ÉŗĶ½į¹¹£¬ÓŠÖśÓŚČĻŹ¶ĪļÖŹµÄŠŌÖŹ”£
£Ø1£©ĻĀĶ¼±ķŹ¾ŗĖµēŗÉŹżĪŖ11~17ŌŖĖŲµÄ×īøßŗĶ×īµĶ»ÆŗĻ¼Ū”£

¢Ł“ÓĶ¼ÖŠæÉŅŌ擳ö£¬ĀČŌŖĖŲµÄ×īøßÕż¼ŪŹĒ____”£
¢ŚČōijŌŖĖŲ¼ČæÉĻŌÕż¼Ū£¬ÓÖæÉĻŌøŗ¼Ū£¬Ōņ×īøßÕż¼ŪÓė×īµĶøŗ¼Ū¾ų¶ŌÖµµÄ“śŹżŗĶĪŖ____”£
¢ŪŠ“³öĶ¼ÖŠŌŖĖŲµÄ»ÆŗĻ¼ŪĖę×ÅŗĖµēŗÉŹżµŻŌöµÄŅ»Ģõ±ä»Æ¹ęĀÉ:____”£
£Ø2£©ŌŚ½šŹō»ī¶ÆŠŌĖ³Šņ±ķĄļ£¬Ķس£ÅÅŌŚĒ°ĆęµÄ½šŹōøüŅ׏§Č„µē×Ó”£»Ų“šŅŌĻĀĪŹĢā:
¢ŁÄ³½šŹōŌ×ӵĽį¹¹Ź¾ŅāĶ¼ĪŖ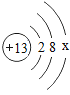 £¬Ōņ×īĶā²ćµē×ÓŹżx=______;Čō×īĶā²ćµē×ÓŹ§Č„£¬“ļµ½Ļą¶ŌĪČ¶Ø½į¹¹£¬øĆ“ųµēĮ£×ӵķūŗÅĪŖ_____”£
£¬Ōņ×īĶā²ćµē×ÓŹżx=______;Čō×īĶā²ćµē×ÓŹ§Č„£¬“ļµ½Ļą¶ŌĪČ¶Ø½į¹¹£¬øĆ“ųµēĮ£×ӵķūŗÅĪŖ_____”£
¢ŚĪŅ¹ś¹Å“ś·¢Ć÷ĮĖ”°ŌųĒą(¼“ĮņĖįĶ)µĆĢś»ÆĪŖĶ”±µÄŹŖ·ØĮ¶Ķ·Ø£¬½«Ģś·ÅČėĮņĖįĶČÜŅŗÖŠæÉŅŌÉś³ÉĶŗĶĮņĖįŃĒĢś£¬Š“³öøĆ·“Ó¦µÄ·ūŗűķ“ļŹ½:____£¬·“Ó¦ÖŠ£¬øüŅ׏§Č„µē×ӵĽšŹōŹĒ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉśŹÆ»ŅµÄÖ÷ŅŖ³É·ÖŹĒŃõ»ÆøĘ£¬ÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆøĘ²¢·Å³ö“óĮæµÄČČ”£ŹŅĪĀŹ±£¬½«ÉśŹÆ»Ņ¼ÓČė±„ŗĶŹÆ»ŅĖ®ÖŠ£¬ÉśŹÆ»Ņ¶ŌČܽāÓ°ĻģµÄÅŠ¶Ļ£Ø²ĪÕÕČēĶ¼Čܽā¶ČĒśĻߣ©£¬“ķĪóµÄŹĒ£Ø””””£©
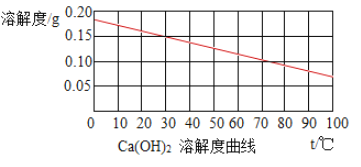
A. ·“Ó¦ÖŠ£¬ŹÆ»ŅĖ®Ź¼ÖÕŹĒ±„ŗĶČÜŅŗ
B. ·“Ó¦ÖŠ£¬ŃõŃõ»ÆøʵÄČܽā¶ČŌö“ó
C. ·“Ó¦ŗó£¬ČÜŅŗµÄÖŹĮæ¼õŠ”
D. ·“Ó¦ŗ󣬻Öø“ÖĮŹŅĪĀŹ±£¬ČÜŅŗµÄÖŹĮæ·ÖŹż²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
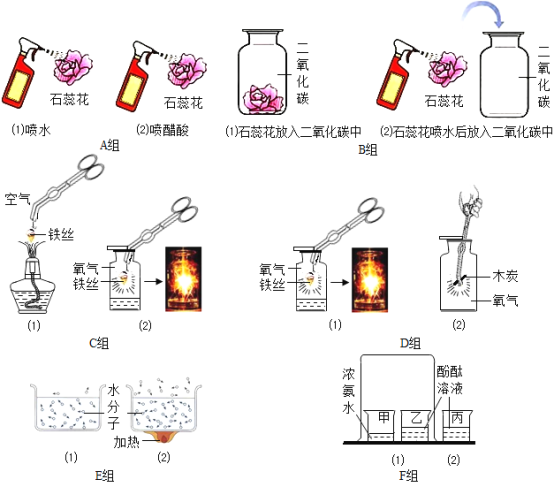
”¾ĢāÄæ”æ¶Ō±ČŹŌŃéŹĒ×ī»ł±¾µÄæĘѧ·ÖĪö·½·Ø£¬Ēėøł¾ŻĻĀĶ¼A©F×éŹŌŃ飬Ķź³ÉĻĀ±ķŹµŃéÉč¼Ę£®
ŹµŃéŠņŗÅ | Ģ½¾æÄæµÄ | Ń”ÓƶŌ±ČŹµŃé£ØĢī×éŠņŗÅ£© |
1 | ²»Ķ¬µÄĪĀ¶Č£¬¶Ō·Ö×ÓŌĖ¶ÆµÄÓ°Ļģ | __ |
2 | __ | C×é |
3 | øÉŌļµÄCO2ÄÜ·ńŹ¹ŹÆČļ±äŗģ | __ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”«EŹĒ³õÖŠ³£¼ūµÄĪļÖŹ£¬ĖüĆĒµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£ØĶ¼ÖŠ”°”ś”±“ś±ķ×Ŗ»Æ¹ŲĻµ£¬”°”Ŗ”Ŗ”±±ķŹ¾Ļą»„·“Ó¦£©”£BæÉÓĆÓŚøÄĮ¼ĖįŠŌĶĮČĄ£¬CŗĶE¶¼ŹĒŃõ»ÆĪļ£¬EŹĒČĖĢåŗ¬Įæ×ī¶ąµÄĪļÖŹ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
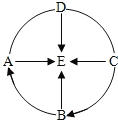
£Ø1£©ĪļÖŹEµÄ»ÆѧŹ½ĪŖ_____£»
£Ø2£©Š“³ö·“Ó¦C”śBµÄ»Æѧ·½³ĢŹ½_____£»
£Ø3£©ČōBŗĶA²»ŗ¬ĻąĶ¬µÄ½šŹōŌŖĖŲ£¬ŌņB”śA·“Ó¦µÄ»ł±¾ĄąŠĶĪŖ_____£»
£Ø4£©ČōBÓėAŗ¬ÓŠĻąĶ¬µÄ½šŹōŌŖĖŲ£¬ŌņAµÄ»ÆѧŹ½ĪŖ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×”¢ŅŅµÄČܽā¶ČĒśĻßČēĶ¼ĖłŹ¾(²»æ¼ĀĒĖ®µÄ±ä»Æ)”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
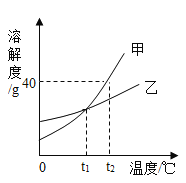
A. øł¾ŻČܽā¶ČĒśĻßæÉÅŠ¶Ļ£¬¼×µÄČܽā¶Č±ČŅŅµÄ“ó
B. t2”ꏱ£¬¼×µÄ±„ŗĶČÜŅŗÖŠČÜÖŹÖŹĮæ·ÖŹżĪŖ40%
C. t2”ꏱ£¬½«¼×”¢ŅŅ±„ŗĶČÜŅŗ·Ö±š½µĪĀÖĮt1”ę£¬Īö³ö¾§Ģå¼×µÄÖŹĮæ“ó
D. t1”ꏱ£¬½«¼×”¢ŅŅ±„ŗĶČÜŅŗ·Ö±šÉżĪĀÖĮt2”ę£¬Į½ČÜŅŗÖŠČÜÖŹÖŹĮæ·ÖŹżĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓėŅŌĻĀĖÄøö±ä»Æ¹ż³Ģ¶ŌÓ¦µÄĖÄøöĶ¼ĻóÖŠ£¬“ķĪóµÄŹĒ£Ø””””£©

A.Ņ»¶ØĮæµÄ±„ŗĶŹÆ»ŅĖ®ÖŠ¼ÓČėŅ»¶ØĮæµÄŃõ»ÆøĘ£¬ČÜŅŗÖŹĮæÓė¼ÓČėŗóŹ±¼äµÄ¹ŲĻµ
B.ĻņpH=1µÄČÜŅŗÖŠ¼ÓĖ®
C.Į½±µČÖŹĮæ×ćĮæµÄĻ”ĮņĖįÖŠ·Ö±š¼ÓČėµČÖŹĮæµÄĆ¾”¢ĀĮ£¬ČÜŅŗÖŹĮæÓėŹ±¼äµÄ¹ŲĻµ
D.t”ꏱ£¬ŌŚŅ»¶ØĮæµÄĀČ»ÆÄĘ²»±„ŗĶČÜŅŗÖŠ²»¶Ļ¼ÓČėĀČ»ÆÄĘ¹ĢĢå
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com