(2013?天桥区三模)如图所示为实验室中常见的气体的制备、干燥、净化、收集和性质实验的部分仪器,试根据题目要求
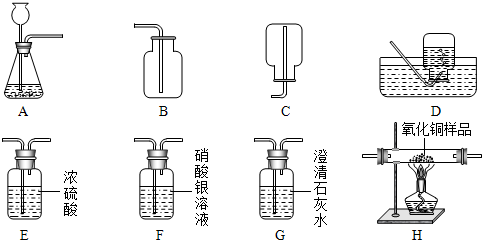
回答下列问题:
(1)用CaCO
3固体和稀盐酸反应制取并收集干燥、纯净的二氧化碳.
①所选仪器的连接顺序为
AFEB
AFEB
(填写仪器序号字母).
②生成二氧化碳时所发生反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.
(2)小瑜同学欲用锌和稀硫酸反应制取氢气并用干燥的氢气测定某不纯氧化铜样品的纯度(杂质为单质铜),小瑜同学设计了实验方案,选择的装置按A→E
1→H→E
2→E
3顺序连接,然后进行实验(H中发生反应的化学方程式为CuO+H
2△Cu+H
2O;E
1、E
2、E
3为3个盛有浓硫酸的洗气瓶,假设试剂对气体的吸收均完全).
①装置A中发生反应的化学方程式为
Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
.
②装置E
1的作用是
吸水干燥氢气
吸水干燥氢气
.
③给氧化铜样品加热前,小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气.你认为他的操作是否正确,并说明理由
正确,先通入氢气,赶走装置中的空气,避免发生爆炸
正确,先通入氢气,赶走装置中的空气,避免发生爆炸
.
④小瑜通过测量反应前后E
2装置的质量变化,来计算氧化铜样品的纯度.除此方法,你认为还可以通过测量来计算氧化铜样品纯度的方法是
称量氧化铜样品反应前后的质量,通过差值计算纯度
称量氧化铜样品反应前后的质量,通过差值计算纯度
.反应一段时间后先停止对玻璃管的加热并持续通入氢气至玻璃管冷却后,将被测样品取出,发现红色固体中存在少量黑色固体,则小瑜测得的氧化铜样品纯度与实际值比较将
偏小
偏小
(填“偏大”、“偏小”、“基本一致”之一).




 (2013?天桥区三模)溶液对动植物的生理活动和人类的生产、科研活动具有很重要的意义.
(2013?天桥区三模)溶液对动植物的生理活动和人类的生产、科研活动具有很重要的意义.
