
【题目】高纯MnCO3是制备电信器材高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
[查阅资料]
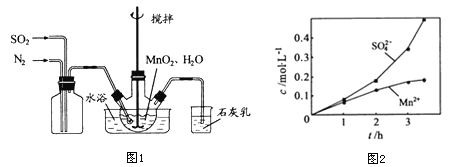
①向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:![]() ;
; ![]()
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③用Na2CO3溶液调节pH为3.5左右,过滤。
④调节滤液pH为6. 5~7.2,加入NH4HCO3,观察到有少量气体生成,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
⑤H2SO3和O2在催化剂的催化作用下生成H2SO4。
[实验探究]
(1)①图1中应该先通入________一段时间后再通入___,原因是_____,石灰乳的作用是_____(用化学方程式表示)。
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图2所示,导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是_______,此时Mn2+的作用是_______。
③反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施是____(写出一 条即可)。
(2)加入的NH4HCO3与MnSO4溶液发生反应,请写出其化学方程式________。
【答案】N2 SO2 排尽装置中的空气防止干扰实验 ![]() Mn2+催化O2与 H2SO3反应生成了H2SO4 催化作用 控制温度或缓慢通入混合气体
Mn2+催化O2与 H2SO3反应生成了H2SO4 催化作用 控制温度或缓慢通入混合气体 ![]()
【解析】
(1)①图1中应该先通入氮气一段时间后,再通入二氧化硫气体,原因是:排尽装置中的空气,防止干扰实验,石灰乳(氢氧化钙)能与二氧化硫反应产生亚硫酸钙沉淀和水的化学方程式:![]() 。
。
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图2所示,导致溶液中Mn2+、SO42-浓度变大的原因是:Mn2+能催化空气中的氧气与 H2SO3反应生成了H2SO4,此时Mn2+的作用是:催化作用;
③反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施是:控制温度或缓慢通入混合气体,使SO2尽可能转化完全;
(2)加入的NH4HCO3与MnSO4溶液发生反应产生硫酸铵、碳酸锰沉淀、二氧化碳气体和水的化学方程式:![]() 。
。


科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具。回答下列问题:
(1)元素周期表中不同元素间最本质的区别是______(填字母)。
A 质子数不同 B 中子数不同 C 相对原子质量不同
(2)元素周期表中氟元素的有关信息如下图所示,下列说法正确的是____(填字母)。
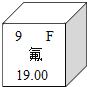
A 氟属于金属元素
B 氟的原子序数是9
C 氟的相对原子质量是19.00g
D 氟与氢组成的化合物的化学式为HF,其中F的化合价为-1价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,将注射器中的溶液缓缓推入 V 型管,有关反应的化学方程式为________________ ,
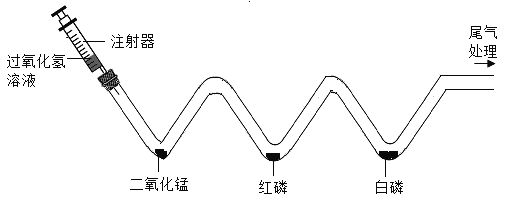
用 80℃的热水加热盛有红磷和白磷的 W 型管时,发现白磷燃烧而红 磷 不 燃 烧 , 由 此 可 以 说 明 燃 烧 需 要 的 条 件是_____________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶溶质质量分数为8%的氢氧化钠溶液,使用后忘盖瓶塞,某兴趣小组同学欲探究该氢氧化钠溶液样品中溶质的成分及含量,进行如下实验探究。请你分析并计算。
(实验过程)
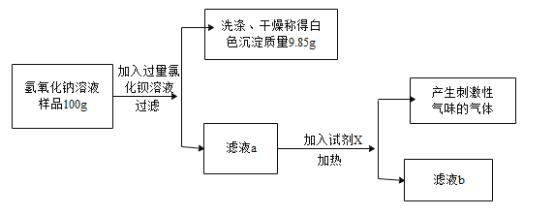
(实验结论)
该氢氧化钠溶液样品中含有氢氧化钠和碳酸钠。
(1)若滤液b中只含有一种阴离子,请你写出滤液a与试剂X发生反应的化学方程式_______________。
(2)请你结合上述实验数据,计算该氢氧化钠溶液样品中碳酸钠的溶质质量分数。(写出计算过程,结果精确到0.1%)
(3)该氢氧化钠溶液样品中氢氧化钠的溶质质量分数为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关物质的检验、区分、分离、提纯所用的试剂或方法错误的是
选项 | 实验目的 | 所用试剂或方法 |
A | 检验 | NaOH溶液或 |
B | 除去生石灰中含有杂质石灰石 | 水或稀盐酸 |
C | 从 | 过滤或蒸发 |
D | 区分失去标签的浓硫酸和稀硫酸 | 水或小木条 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,“珍惜水,节约水、保护水”是每个公民的义务和责任。
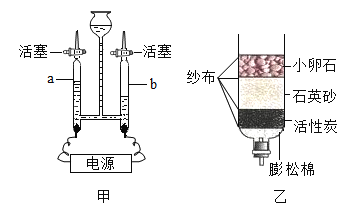
(1)用图甲所示装置进行电解水的实验,b中收集到的气体是_________,b连接直流电源的_____极(填“正”或“负”)。检验a中的气体的方法为_________________。请写出该实验反应的文字表达式:_______________________________________,该反应的基本类型为________________。
(2)四川水资源丰富,但分布不均。有些村民用地下水作为生活用水,人们常用_______检验地下水是硬水还是软水;生活中常用__________的方法降低水的硬度;某同学自制图乙所示简易净水器,图中活性炭的主要作用是___________,属于________变化。(填“物理”或“化学”)
(3)在天然水的人工净化过程中,可利用沉降、吸附、过滤、蒸馏等方法净化,其中净化程度最高的是__________。其中加入少量的明矾的作用是___________,玻璃棒在过滤过程中的作用是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是A、B、C三种固体物质的溶解度曲线.如图所示,完成下列问题。
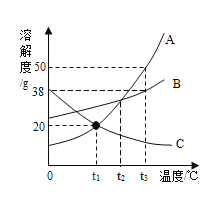
(1)t3℃时,A、B、C三种物质溶解度由大到小的顺序是____________。
(2)若A中有少量B时,采取_____的结晶方式提纯A。
(3)将t1℃时的A、B、C三种物质的饱和溶液温度升高到t2℃,所得溶液溶质质量分数的大小关系是_____。
(4)将t3℃时等质量的A、B两种物质的饱和溶液降温到t2℃,对所得溶液的说法正确的是_____。
A 溶剂质量:A<B B 溶质质量:A<B
C 溶液质量:A>B D 溶质质量分数A=B
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组为测定黄铜中锌的质量分数,进行如下实验:
实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取黄铜样品加入烧杯中,使之与盐酸恰好完全反应 | ④特反应完全后,称重 |
实验图示 |
| |||
实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为150.0g | 黄铜样品的质量为20.0g | 烧杯和其中混合物的量为169.6g |
涉及反应的化学方程式:Zn+2HCl==ZnCl2+H2↑请完成下列问题:
(1)步骤③可观察到的现象是:_____。
(2)该实验中生成的氢气的质量是_____g。
(3)求该黄铜样品中锌的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】作为重要的能源,燃料对于人类社会是非常重要的。
(1)目前,人们使用的燃料大多来自化石燃料,如煤、石油和________等。将石油加热炼制,利用石油中各成分的________不同,将它们分离,可得到不同的产品。
(2)下图所示为粉尘爆炸实验,该实验说明,可燃物与氧气的_________,燃烧就越剧烈。

(3)氢气被认为是理想的清洁、高能燃料。下图所示为实验室制取氢气的简易装置,选择向下排空气法收集氢气的原因是_________。
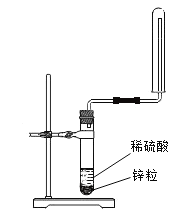
(4)某化学兴趣小组用2g锌粒与30mL质量分数为30%的稀硫酸反应制取氢气,待均匀产生气泡后采用一定方法测量生成氢气的速率,下图所示为生成氢气的速率随时间的变化趋势。
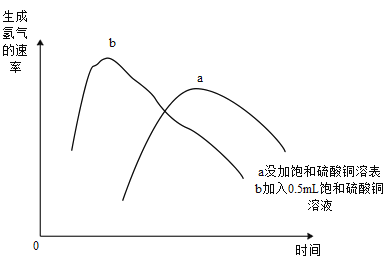
①对比曲线a和b,发现加入0.5mL饱和硫酸铜溶液能够________生成氢气的速率(填“加快”或“减慢”)。查阅资料得知,出现该变化可能是因为锌与硫酸铜反应生成少量铜,锌与铜形成了原电池,请写出锌与硫酸铜反应的化学方程式:___________。
②观察曲线a,锌粒与稀硫酸反应时,生成氢气的速率呈现出先增大后减小的变化趋势。已知:温度、反应物的浓度是影响化学反应速率的重要因素。生成氢气的速率先增大的主要原因可能是__________;生成氢气的速率后减小的主要原因可能是随着反应的进行,硫酸的浓度逐渐减小。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com