
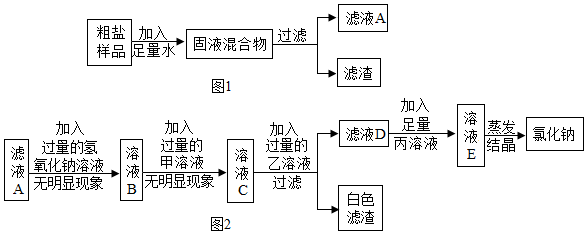
分析 (1)玻璃棒用途有搅拌、引流、转移物质等;
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氯化钡反应生成碳酸钡沉淀和氯化钠;
稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳.
解答 解:(1)除去粗盐中不溶性杂质,过滤操作使用了玻璃棒,其作用是引流.
故填:引流.
(2)①甲应该是氯化钡溶液,用来检验溶液中是否含有硫酸钠并且能够除去硫酸钠.
故填:氯化钡.
②加入氢氧化钠溶液无明显现象,说明溶液中不含有氯化镁,加入氯化钡溶液无明显现象,说明溶液中不含有硫酸钠,加入碳酸钠溶液时产生白色沉淀,白色沉淀中一定含有碳酸钠和氯化钡反应生成的碳酸钡沉淀,可能含有碳酸钠和氯化钙反应生成的碳酸钙沉淀,即溶液中可能含有氯化钙,因此滤液A中溶质的组成可能为氯化钠,或氯化钠和氯化钙.
故填:氯化钠,或氯化钠和氯化钙.
③向白色滤渣中加入过量的稀盐酸时,滤渣可能只有碳酸钡,也可能是碳酸钡和碳酸钙,碳酸钡和碳酸钙都能够和稀盐酸反应,因此沉淀全部溶解.
故填:全部溶解.
④向滤液D中加入足量丙溶液即稀盐酸时,发生的化学反应且属于中和反应的是稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl═NaCl+H2O.
故填:NaOH+HCl═NaCl+H2O.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com